
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
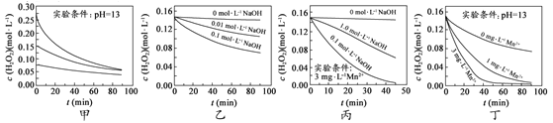
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
【答案】D
【解析】
A.图甲中溶液的pH相同,但浓度不同,浓度越大,相同时间内浓度的变化量越大,由此可知:在相同pH条件下,双氧水浓度越大,双氧水分解速率越快,A错误;
B.图乙中H2O2浓度相同,但加入NaOH浓度不同,说明溶液的pH不同,NaOH浓度越大,相同时间内双氧水浓度变化量越大,由此得出:当双氧水浓度相同时,溶液的pH越大,双氧水分解速率越快,B错误;
C.图丙中少量Mn2+存在时,相同时间内双氧水浓度变化量:0.1mol/LNaOH溶液>1.0mol/LNaOH溶液>0mol/LNaOH溶液,C错误;
D.图丁中溶液的pH相同,Mn2+浓度越大,相同时间内双氧水浓度变化量越大,图丙中说明催化剂的催化效率受溶液的pH值影响,由此得出:碱性溶液中,Mn2+对H2O2分解速率的影响大,D正确;
故合理选项是D。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是_____,X和Y中电负性较大的是__(填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
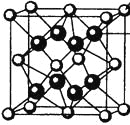
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是_______。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
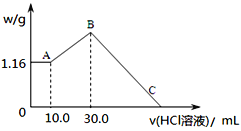
①A点的沉淀物的化学式为______________。
②写出A点至B点发生反应的离子方程式:_________________。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:NaOH溶液、_______和盐酸。
④C点(此时沉淀恰好完全溶解)HCl溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36gcm-3.实验室制备少量1-溴丙烷的主要步骤如下:
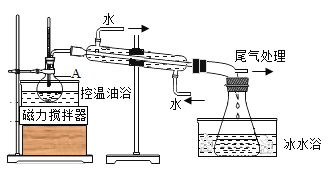
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
(1)步骤1发生反应的方程式为______
(2)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(3)反应时生成的主要有机副产物有______。
(4)反应过程中可以观察到A的上方出现红棕色气体,其电子式为______。
(5)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是______。同时可以观察到的现象是______。
(6)步骤4中三次洗涤分别洗去的主要杂质是①______②______③______。
(5)步骤4中②的Na2CO3溶液还可以用下列哪个试剂代替______
A. NaOH溶液 B. NaI溶液 C. Na2SO3溶液 D. CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______,氧化产物与还原产物的物质的量之比为_______。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):① ___KMnO4+____K2S+______===___K2MnO4+___K2SO4+___S↓+______。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为___。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程如图所示,下列说法不正确的是( )

A. 在沉淀池中应先通入氨气,再通入二氧化碳气体
B. 该反应原理: NH3+CO2+H2O=HCO3-+NH4+
C. 循环1中X是二氧化碳
D. 在过滤后的母液中加入氯化钠粉末、通入氨气,搅拌,经冷却结晶后可得氯化铵晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是
A. 称量NaCl固体时砝码上有杂质
B. 没有洗涤溶解NaCl固体的烧杯和玻璃棒
C. 定容时加水加多了,用滴管吸出溶液至刻度线
D. 定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:
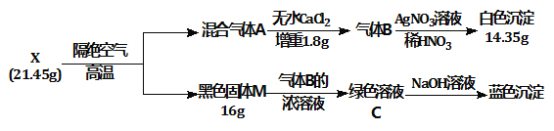
请回答:
(1) X的化学式是________。
(2) 绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___________________________。
(3) 加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是
A.FeS2![]() SO3
SO3![]() H2SO4
H2SO4
B.NaCl(aq)![]() Na
Na![]() Na2O2
Na2O2
C.Fe![]() FeSO4(aq)
FeSO4(aq)![]() Fe(OH)2
Fe(OH)2![]() Fe2O3
Fe2O3
D.Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() Fe
Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com