
【题目】在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是_______。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
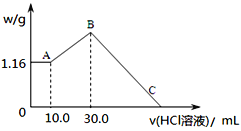
①A点的沉淀物的化学式为______________。
②写出A点至B点发生反应的离子方程式:_________________。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:NaOH溶液、_______和盐酸。
④C点(此时沉淀恰好完全溶解)HCl溶液的体积为________mL。
【答案】 A Mg(OH)2 AlO2-+H++H2O= Al(OH)3↓ CO2 130.0(130也给分)
【解析】(1)金属钠非常活泼,能够与水、氧气等物质发生反应,但与石蜡油或煤油不反应,可以保存在石蜡油或煤油中,A正确;铝的熔点低,加热后会熔化,但铝在氧气中燃烧生成氧化铝,因为氧化铝的熔点高,加热时氧化膜包裹着内层的熔化的铝而不会低落,B错误;铁单质与水蒸气反应生成四氧化三铁而非氧化铁,C错误;正确选项A。
(2)从题给信息中可知:产生的白色沉淀加盐酸后,沉淀质量不变,说明原溶液中氢氧化钠过量,所以1.16g白色沉淀为氢氧化镁,而氢氧化铝沉淀溶于过量的氢氧化钠,溶液中存在偏铝酸根离子,继续加盐酸,会发生AlO2-+H++H2O= Al(OH)3↓ ,沉淀达到最大值,为氢氧化镁和氢氧化铝沉淀质量之和(B点);接着再加入足量的盐酸,两种沉淀都溶于酸中,沉淀消失;
①A点的沉淀物为氢氧化镁,化学式为Mg(OH)2;正确答案:Mg(OH)2。
②写出A点至B点发生反应为偏铝酸根离子与适量盐酸反应生成氢氧化铝沉淀,离子方程式: AlO2-+H++H2O= Al(OH)3↓;正确答案:AlO2-+H++H2O= Al(OH)3↓。
③含有MgCl2和AlCl3的混合液中,先加入足量的氢氧化钠溶液,生成氢氧化镁沉淀和偏铝酸钠溶液,过滤,得到沉淀氢氧化镁,再加适量的盐酸,生成MgCl2;滤液为偏铝酸钠溶液,通入足量二氧化碳气体,生成氢氧化铝沉淀和碳酸氢钠溶液,过滤得到沉淀固体,再加入适量盐酸,得到AlCl3,从而实现二者的分离;正确答案:CO2。
④根据上述分析可知:氢氧化镁沉淀质量为1.16克,物质的量为0.02 mol,A→B过程为AlO2-+H++H2O= Al(OH)3↓,共消耗盐酸的量为(30-10)×10-3×1=0.02 mol,生成Al(OH)3沉淀的量为0.02 mol,两种沉淀恰好与盐酸反应只生成氯化镁和氯化铝溶液,根据氯离子守恒可得:V(HCl)×1=0.02×2+0.02×3=0.1, V(HCl)=0.1L=100mL, C点(此时沉淀恰好完全溶解)HCl溶液的体积为30+100=130.0 mL,正确答案:130.0(130也给分)。


科目:高中化学 来源: 题型:
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
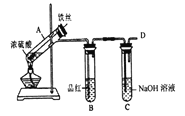
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘具有多种放射性同位素. ![]() I俗称“碘131”,广泛地用于医学诊断作为追踪剂和甲状腺内分泌失调症的治疗.下列有关
I俗称“碘131”,广泛地用于医学诊断作为追踪剂和甲状腺内分泌失调症的治疗.下列有关 ![]() I叙述正确的是( )
I叙述正确的是( )
A.碘元素的相对原子质量为131
B.![]() I是一种新发现的碘的核素
I是一种新发现的碘的核素
C.![]() I位于元素周期表中第4周期ⅦA族
I位于元素周期表中第4周期ⅦA族
D.![]() I核内的中子数与核外电子数之差为29
I核内的中子数与核外电子数之差为29
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸(H2FeCO4)是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)Na2FeO4中Fe的化合价为______________________。.
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为__________________。
(3)在工业上制备Na2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:
2FeSO4+6Na2O2=aNa2FeO4+M↑+2Na2O+2Na2SO4
①a=_____________。
②每生成1mol M,该反应转移电子的物质的量为_________mol。
Ⅱ.湿法制备的工艺流程如下:

己知:Na2FeO4在强碱性溶液中的溶解度较小。
③反应a中,生成物除了Na2FeO4外,另一种盐的化学式为 _____________。
④一系列操作包括过滤、___________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)下列实验操作或对实验事实的描述中,正确的是(填序号)
①为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
②化学药品着火,都要立即用水或泡沫灭火器灭火
③配制一定物质的量浓度的稀硫酸溶液时,量取浓硫酸后的量筒要用蒸馏水洗涤,并把洗涤液转入容量瓶中
④配制一定物质的量浓度的溶液在定容时,俯视容量瓶的刻线,会使配制的浓度偏高
⑤检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
(2)将下列物质进行分类:
①11H 与13H ②O2与O3 ③乙醇与甲醚(CH3﹣O﹣CH3)④ 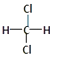 与
与 
⑤CH3CH2CH2CH3与CH3﹣CH(CH3)﹣CH3⑥C60与金刚石 ⑦乙醇与甘油
互为同位素的是(填编号,下同);互为同素异形体的是互为同分异构体的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取物质、探究物质的性质是学习化学必备的素养之一。
回答下列问题。
(1)实验室从含碘废液(除水外含CCl4、I2、I-等)中回收碘,其实验流程如下。

回答下列问题:
①物质X的名称为________;
②操作Ⅰ选用的装置为______(填标号);

③含碘废液中加入稍过量的Na2SO3溶液将I2还原为I-,反应的离子方程式为___。
④氧化剂Y可用Cl2,也可以用H2O2。将同物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为________。
(2)某研究小组查阅资料知:氧化性的强弱顺序为:Cl2>IO3->I2。用如图装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。

①NaOH溶液的作用是______,反应的离子方程式为___________。
②溶液由黄色最后变为无色所发生反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com