
【题目】高铁酸(H2FeCO4)是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)Na2FeO4中Fe的化合价为______________________。.
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为__________________。
(3)在工业上制备Na2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:
2FeSO4+6Na2O2=aNa2FeO4+M↑+2Na2O+2Na2SO4
①a=_____________。
②每生成1mol M,该反应转移电子的物质的量为_________mol。
Ⅱ.湿法制备的工艺流程如下:

己知:Na2FeO4在强碱性溶液中的溶解度较小。
③反应a中,生成物除了Na2FeO4外,另一种盐的化学式为 _____________。
④一系列操作包括过滤、___________、_______________。
【答案】 +6 4H2FeO4+2H2O=4Fe(OH)3+3O2↑ 2 10 NaCl 洗涤 (低温)干燥
【解析】本题主要考查高铁酸钠的性质和制法。
(1)根据化合价代数和为零的原则,由钠元素+1价和氧元素-2价得到Na2FeO4中Fe的化合价为+6。.
(2)生成物中气体为氧气,红褐色沉淀为氢氧化铁,则H2FeO4与水反应的化学方程式为4H2FeO4+2H2O=4Fe(OH)3+3O2↑。
(3)Ⅰ.①M气体不含有钠元素,由钠元素守恒可得a=2。
②M~10e-,每生成1molM,该反应转移电子的物质的量为10mol。
Ⅱ.③反应a中,生成物除了Na2FeO4外,另一种盐的化学式为NaCl。
④一系列操作包括过滤、洗涤、(低温)干燥。


科目:高中化学 来源: 题型:
【题目】PVDC是世界上目前唯一大工业化生产、可以承受高温蒸煮、具有高阻隔性能的塑料,可作为保鲜食品的包装材料,用它作为中间层,制造多层复合材料,更是目前塑料包装行业技术进步和技术创新的前沿阵地。PVDC是聚偏二氯乙烯的英文缩写,它的结构简式是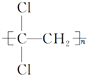 。下列说法错误的是( )
。下列说法错误的是( )
A. PVDC是由单体CCl2===CH2发生加聚反应合成的
B. PVDC是由单体CCl3CH3发生缩聚反应合成的
C. PVDC也有很大的缺点,如在空气中熔融可分解,分解成为HCl、炭黑、水蒸气等,会污染空气
D. PVDC的单体可发生加成、取代、氧化、消去等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E五种元素从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如右图所示,下列说法正确的是( ) ![]()
A.E元素的最高化合价为+7价时,D元素的负化合价可为﹣2价
B.A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.组成糖类、油脂、蛋白质的元素都是C、H、O三种
B.葡萄糖和蔗糖不互为同分异构体,但属于同系物
C.蛋白质在碱性条件下水解为丙三醇和高级脂肪酸钠
D.“地沟油”经过加工处理后,可以用来制生物柴油和肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有烃的含氧衍生物A(A分子中只有一种官能团),还原A时形成醇B,氧化A时形成酸C。由B、C反应可生成高分子化合物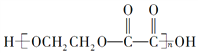 ,下列叙述中错误的是( )
,下列叙述中错误的是( )
A. A属于醛类,其相对分子质量为58,1 mol A与足量的银氨溶液反应可生成4 mol Ag
B. B在一定条件下可通过缩聚反应得到一种新的高聚物
C. 高分子化合物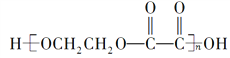 的组成与B、C等物质的混合物的组成相同
的组成与B、C等物质的混合物的组成相同
D. B、C生成高聚物的反应为缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无纺布制成的医用口罩在抗击新型冠状病毒过程中发挥了重要作用,无纺布的主要原料是聚丙烯树脂。下列说法不正确的是( )
A.无纺布制成的医用口罩能有效预防病毒传染
B.聚丙烯树脂属于合成有机高分子材料
C.合成聚丙烯树脂的单体是丙烯
D.丙烯和聚丙烯树脂均属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
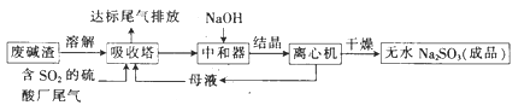
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为_______________(不考虑H2O与SO2反应)。
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是___________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为____________(填“浊液”“胶体”或“溶液”)。
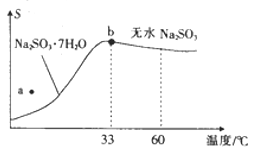
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为________________(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1,为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=_______mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:
![]()
①洗涤时使用的试剂最好为____________(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y)_____________ (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为 (若不能,则此空不填);若不能,则理由是_____________(若能,则此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一系列物质: NaCl、 Cl2、 NaClO、 Cl2O5、 HClO4是按某一规律排列的,下列组合中也完全照此规律排列的是( )
A. Na2CO3、C、CO2、CO、NaHCO3
B. Na2S、S、SO2、Na2SO3、Na2SO4
C. NH4Cl、N2、NaNO2、NO2、HNO3
D. P2O5、H3PO4、Na3PO4、Na2HPO4、NaH2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌冶炼过程中会产生大量的铅浮渣,其主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。利用铅浮渣生产硫酸铅的流程如下。下列说法不正确的是
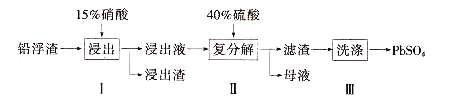
A. 步骤Ⅰ中反应的离子方程式是:Pb+4H++2NO=Pb2++2NO↑+2H2O
B. 复分解反应的方程式是:Pb(NO3)2+H2SO4= PbSO4↓+2HNO3
C. 为保证产品纯度,需控制硝酸的量以为防止Ag被溶解
D. 步骤Ⅱ得到的粗产品PbSO4 含有少量CaSO4杂质,还需用Pb(NO3)2溶液多次洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com