
【题目】锌冶炼过程中会产生大量的铅浮渣,其主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。利用铅浮渣生产硫酸铅的流程如下。下列说法不正确的是
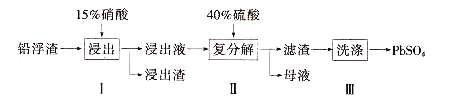
A. 步骤Ⅰ中反应的离子方程式是:Pb+4H++2NO=Pb2++2NO↑+2H2O
B. 复分解反应的方程式是:Pb(NO3)2+H2SO4= PbSO4↓+2HNO3
C. 为保证产品纯度,需控制硝酸的量以为防止Ag被溶解
D. 步骤Ⅱ得到的粗产品PbSO4 含有少量CaSO4杂质,还需用Pb(NO3)2溶液多次洗涤
【答案】A
【解析】A.根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,故反应方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,对应的离子方程式是3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O,故A错误;B.Pb(NO3)2和稀硫酸发生复分解反应的方程式是Pb(NO3)2+H2SO4= PbSO4↓+2HNO3,故B正确;C.若硝酸过量,则过量的硝酸会和银反应生成硝酸银,产品中会有杂质,所以步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液,故C正确;D.硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4,故D正确;答案为A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高铁酸(H2FeCO4)是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)Na2FeO4中Fe的化合价为______________________。.
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为__________________。
(3)在工业上制备Na2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:
2FeSO4+6Na2O2=aNa2FeO4+M↑+2Na2O+2Na2SO4
①a=_____________。
②每生成1mol M,该反应转移电子的物质的量为_________mol。
Ⅱ.湿法制备的工艺流程如下:

己知:Na2FeO4在强碱性溶液中的溶解度较小。
③反应a中,生成物除了Na2FeO4外,另一种盐的化学式为 _____________。
④一系列操作包括过滤、___________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( ) 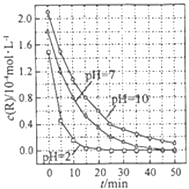
A.在0﹣50min之间,pH=2 和 pH=7 时 R 的降解百分率相等
B.溶液酸性越强,R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20﹣25min之间,pH=10 时 R 的平均降解速率为 0.04molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4==FeSO4+Cu。有关该反应的说法正确的是 ( )
A. Fe是氧化剂 B. CuSO4是还原剂
C. Fe被氧化 D. CuSO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于水解反应且使溶液显酸性的是( )
A.NH4++H2ONH3H2O+H+
B.HCO3﹣+H2OCO32﹣+H3O+
C.S2﹣+H2OHS﹣+OH﹣
D.NH3+H2ONH4++OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,R,M是元素周期表中原子序数依次增大的五种短周期元素,其相关信息如下表:
元素 | 相关信息 |
X | X的一种核素的原子核中没有中子 |
Y | Y原子的核外电子占据4个原子轨道 |
Z | Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
R | R是地壳中含量最高的元素 |
M | M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |
(1)Y,Z,R的第一电离能从大到小的顺序是(填元素符号)
(2)Z,R的最简单氢化物中稳定性强的是 , 沸点高的是(填化学式)
(3)甲是由上述3种元素组成的常见化合物,常温下pH=3的甲溶液中由水电离c(H+)=10﹣3mol/L,则甲的化学式是 .
(4)直线型分子Y2Z2中所有原子都达到8电子稳定结构,则分子中σ键与π键的个数之比是 .
(5)常温下0.58gY4H10完全燃烧放出29kJ的热量,请写出Y4H10燃烧热的热化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com