
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
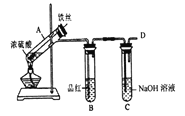
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
【答案】 检验SO2是否除尽 品红溶液不褪色,澄清石灰水变浑浊 增大铁丝与硫酸的接触面积,加快反应速率,使反应充分进行 Fe+2H+=Fe2++H2↑ 钝化 SO2 取少量溶液,滴加KSCN溶液,若溶液呈血红色则证明有Fe3+存在 反应的温度、反应物的浓度、反应物用量
【解析】Ⅰ. (1)由装置图分析可知,用酸性高锰酸钾除去未反应的SO2,为确保进入澄清石灰水中的气体为CO2,试剂X应该是品红溶液,用来检验SO2是否除尽;
(2)当观察到品红溶液不褪色,澄清石灰水变浑浊,即说明SO2把CO2置换出来了,即证明H2SO3的酸性比H2CO3的强;
Ⅱ.(3)铁丝绕成螺旋状的目的增大铁丝与硫酸的接触面积,加快反应速率;
(4)实验1中,铁与稀硫酸反应的离子方程式为Fe+2H+=Fe2++H2↑;
(5)实险2中的现象是铁丝表面迅速发黑(Fe3O4),说明浓硫酸具有强的氧化性,迅速在铁的表面氧化生成致密的氧化膜,即黑色的Fe3O4,并有少量气体产生,但反应很快停止是由于致密的氧化膜阻止了浓硫酸与铁的进一步接触,使反应停止了,这种现象被称为钝化;
(6)试管B中品红溶液褪色,说明A中产生的气体是SO2;检测装置A的溶液中含有Fe3+,可取少量该溶液,滴加几滴KSCN溶液,若溶液呈血红色则证明有Fe3+存在;
(7)实验1说明稀硫酸与铁反应生成H2,实验2说明浓硫酸在常温下使铁钝化,故实验1和实验2比较可知,硫酸的浓度影响着铁和硫酸反应的产物;实验3说明浓硫酸在加热时与铁反应,产生大量的SO2气体,所以实验2和实验3比较可得,反应的温度影响着铁和硫酸反应的产物;但随着反应的进行,浓硫酸逐渐变为稀硫酸,而稀硫酸与铁反应将产生具有可燃性的H2,可是在实验3的D处始终未检测到可燃性气体,说明浓硫酸的用量非常大,由此分析反应物的浓度、反应的温度和反应物用量都是影响铁和硫酸反应产物多样性的因素。


科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)及其盐(如NaN3、NH4N3、CuN3等)都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)6(H3O)3(NH4)4Cl。回答下列问题:
(1)PHAC中“N3”的化合价为______。N2F2的电子式为_______。
(2)汽车安全气囊中的NaN3可发生下列反应:
NaN3(s)=Na(s)+3/2N2(g) △H1;
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H1;
则反应CuO(s)+2Na(s)=Na2O(s)+Cu(s) △H=_______(用△H1和△H2表示)
(3)25℃时,将lmolNH4N3投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol, 则NH4N3的平衡转化率为_______,25℃时该反应的平衡常数K=________。
(4)氢叠氮酸(HN3)易溶于水,且酸性与醋酸相近。
①HN3在水溶液中的电离方程式为_______________.
② 0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合,混合溶液中各离子浓度由大到小的顺序为__________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq)![]() 2CuN3(s)+S2-(aq)的平衡常数K=_________.
2CuN3(s)+S2-(aq)的平衡常数K=_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“千年大计、国家大事”,雄安新区无疑是今年最受瞩目的地区。不过,近日媒体报道河北廊坊、天津等地存在超大规模的工业污水渗坑,给雄安新区的水环境带来隐患,目前正采用多种方法对污水进行处理,改善水资源状况。
(1)在微生物作用的条件下,废水中的NH4+经过两步反应氧化成NO3-,两步反应的能量变化示意图如下:
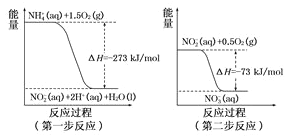
①第一步反应是______反应(选填“放热”或“吸热”),判新依据是_________。1mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式为_____________。
②一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该过程中CH3OH反应生成CO2,则参加反应的还原剂和氧化剂的物质的量之比为______.
(2)二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂,可以投入废水中清除污染物。
①二氧化氯可以将废水中的氰化物(CN-)氧化成两种无污染气体.写出离子方程式________。
②废水中的重金属离子的危害性很大,二氧化氯能够在弱酸性溶液中把二价锰离子氧化成不溶于水的二氧化锰(MnO2),写出反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA
B.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣数目为0.2NA
C.标准状况下,22.4LCHCl3含有的分子数为NA
D.1L 0.1molL﹣1的硫化钠溶液中硫离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 不溶于水和稀硫酸,制取流程如下:

请回答下列问题:
(1)溶液X是_______。
(2)在黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 中,x、y、z的代数关系式为_______。
(3)检验滤液中是否存 在K+的操作是_______。
(4)黄钾铵铁矾的化学式可通过下列实验测定:
步骤1: 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶配制成100.00mL 溶液A。
步骤2: 最取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g。
步骤3: 量取25.00mL溶液A,加入足最NaOH溶液,加热,收集到标准状下气体224mL,同时有红褐色沉淀生成。
步骤4: 将步骤3所得沉淀过滤、洗涤、灼烧,最终得固体4.80g。
①步骤1配制溶液A所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需_______。
②根据以上实验数据计算黄钾铵铁矾中的n(OH-)∶n(SO42-)的比值为_______。(写出必要的计算过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)标准状况下,1.12LCH4的质量为_______g。
(2)与3.2gSO2所含的O原子数相等的NO2的质量为_______g。
(3)配制500mL1.0mol·L-1CuSO4溶液时,在移液洗涤后,摇动容量瓶有少量液体溅出,则所配溶液物质的量浓变会_______(选填“偏高”、“偏低”、“无影响”)。
(4)把2.0mol·L-1Na2SO4溶液和1.0mol·L-1H2SO4溶液等体积混合(假设混合后溶液的体积为两者体积之和),则SO42-的物质的量浓度为_______mol·L-1。
(5)浓氨水可用于检验氯气管道是否漏气,其原理是8NH3+3Cl2=6NH4Cl+N2。该反应中氧化剂与还原剂的物质的最之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下:
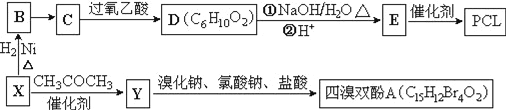
已知:①X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]() 。
。
②![]() 。
。
③RCOCH2R′![]() RCOOCH2R′。
RCOOCH2R′。
(1)B的名称是_________________。
(2)B→C还需要的反应试剂及条件是___________。C→D的反应类型是______________________。
(3)写出X→Y的化学方程式:_______________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗__molNaOH。
(5)符合以下条件的D的同分异构体有__种(不考虑空间异构)。
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:
![]()
利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图:________________________________。
,写出合成该涂料的反应流程图:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能够鉴定卤代烃中卤元素的存在的操作是( )
A.在卤代烃中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,再加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是_______。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
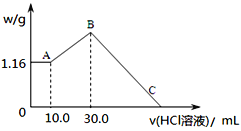
①A点的沉淀物的化学式为______________。
②写出A点至B点发生反应的离子方程式:_________________。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:NaOH溶液、_______和盐酸。
④C点(此时沉淀恰好完全溶解)HCl溶液的体积为________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com