
【题目】氢叠氮酸(HN3)及其盐(如NaN3、NH4N3、CuN3等)都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)6(H3O)3(NH4)4Cl。回答下列问题:
(1)PHAC中“N3”的化合价为______。N2F2的电子式为_______。
(2)汽车安全气囊中的NaN3可发生下列反应:
NaN3(s)=Na(s)+3/2N2(g) △H1;
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H1;
则反应CuO(s)+2Na(s)=Na2O(s)+Cu(s) △H=_______(用△H1和△H2表示)
(3)25℃时,将lmolNH4N3投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol, 则NH4N3的平衡转化率为_______,25℃时该反应的平衡常数K=________。
(4)氢叠氮酸(HN3)易溶于水,且酸性与醋酸相近。
①HN3在水溶液中的电离方程式为_______________.
② 0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合,混合溶液中各离子浓度由大到小的顺序为__________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq)![]() 2CuN3(s)+S2-(aq)的平衡常数K=_________.
2CuN3(s)+S2-(aq)的平衡常数K=_________.
【答案】 –l ![]() △H2-2△H1 40% 0.0256 HN3
△H2-2△H1 40% 0.0256 HN3![]() H++N3- c(N3-)>c(Na+)>c(H+)>c(OH-) 1.0×10-31
H++N3- c(N3-)>c(Na+)>c(H+)>c(OH-) 1.0×10-31
【解析】(1)根据正负价代数和为0可知PHAC中“N3”的化合价为-价。根据8电子稳定结构可知N2F2的电子式为![]() 。(2)已知:
。(2)已知:
①NaN3(s)=Na(s)+3/2N2(g) △H1;
②2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H1;
则根据盖斯定律可知②-①×2即得到反应CuO(s)+2Na(s)=Na2O(s)+Cu(s) △H=△H2-2△H1。
(3)根据反应的方程式可知
NH4N3=2H2↑+2N2↑
起始浓度(mol/L) 0.5 0 0
转化浓度(mol/L) x 2x 2x
平衡浓度(mol/L) 0.5-x 2x 2x
则2x+2x=1.6/2,解得x=0.2
因此NH4N3的平衡转化率为0.2/0.5×100%=40%,25℃时该反应的平衡常数K=![]() 。
。
(4)①氢叠氮酸(HN3)易溶于水,且酸性与醋酸相近,因此HN3在水溶液中的电离方程式为HN3![]() H++N3-。②由于酸性与醋酸相近,因此0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合后显酸性,则混合溶液中各离子浓度由大到小的顺序为c(N3-)>c(Na+)>c(H+)>c(OH-)。③相同温度下反应Cu2S(s)+2N3-(aq)
H++N3-。②由于酸性与醋酸相近,因此0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合后显酸性,则混合溶液中各离子浓度由大到小的顺序为c(N3-)>c(Na+)>c(H+)>c(OH-)。③相同温度下反应Cu2S(s)+2N3-(aq)![]() 2CuN3(s)+S2-(aq)的平衡常数K=
2CuN3(s)+S2-(aq)的平衡常数K=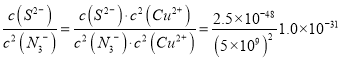 。
。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】乙烯与乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45g水,则下列说法错误的是( )
A.当a=1时,乙烯和乙烷的物质的量之比为1:1
B.当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 ![]() 时,则b=3
时,则b=3
C.当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 ![]() 时,则CO和CO2的物质的量之比为3:1
时,则CO和CO2的物质的量之比为3:1
D.a的取值范围为 ![]() <a<
<a< ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各条件下可能共存的离子组是( )
A. 某无色溶液中: ![]() 、Na+、Cl-、
、Na+、Cl-、![]()
B. 由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、![]() 、
、![]()
C. 在c(H+)=1×10-13 mol·L-1的溶液中: ![]() 、Al3+、
、Al3+、![]() 、
、![]()
D. 在pH=1的溶液中:K+、Fe2+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义.
(1)298K,101KPa时,在1L水中可溶解0.09mol氯气,实验测得溶于说的氯气约有 ![]() 与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
(2)用水稀释0.1mol/L氨水,溶液中随着水量的增加而增大的是(填字母)
a.c(OH﹣) b.c(NH3H2O) c.c(NH4+)c(OH﹣)
d.NH3H2O的电离程度 e.溶液的导电性
当溶液适当升高温度(不考虑NH3H2O分解和NH3逸出),上述数据增大的是;在溶液中加入少量NH4Cl固体(不考虑溶液温度变化),上述数据增大的是;当加入少量NaOH固体(不考虑溶液温度变化),上述数据增大的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据电解质溶液的知识,回答下列问题:
已知0.1mol·L-1的NaHSO4溶液中H+的浓度为0.1mol·L-1,
(1)写出NaHSO4在水溶液中的电离方程式:________________________________________。
(2)若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,离子方程式为_______________。
(3)若向Ba(OH)2溶液中滴加NaHSO4溶液至溶液恰好呈中性,反应的离子方程式为___。
(4)向NaAlO2中滴加NaHSO4溶液,现象为:________________;请你用离子方程式解释产生上述现象的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大
B.对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小
C.活化分子间发生的碰撞为有效碰撞
D.使用催化剂,活化分子百分数增多,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
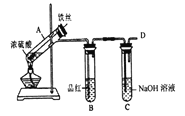
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com