
【题目】乙烯与乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45g水,则下列说法错误的是( )
A.当a=1时,乙烯和乙烷的物质的量之比为1:1
B.当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 ![]() 时,则b=3
时,则b=3
C.当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 ![]() 时,则CO和CO2的物质的量之比为3:1
时,则CO和CO2的物质的量之比为3:1
D.a的取值范围为 ![]() <a<
<a< ![]()
【答案】C
【解析】解:A.设乙烯与乙烷的物质的量分别为xmol、ymol,根据二者物质的量之和与H原子守恒列方程,则:x+y=1,4x+6y= ![]() ×2,解得:x=0.5,y=0.5,故n(C2H4):n(C2H6)=0.5mol:0.5mol=1:1,故A正确;
×2,解得:x=0.5,y=0.5,故n(C2H4):n(C2H6)=0.5mol:0.5mol=1:1,故A正确;
B.根据碳元素守恒可知,反应后CO和CO2混合气体的物质的量之和为1mol×2=2mol,故 ![]() b=2,解得:b=3,故B正确;
b=2,解得:b=3,故B正确;
C.设反应后CO和CO2的物质的量分别为amol、bmol,根据二者之和与氧原子守恒列方程,则:a+b=2,a+2b=3×2﹣ ![]() ,解得:a=0.5,b=1.5,故n(CO):n(CO2)=0.5mol:1.5mol=1:3,故C错误;
,解得:a=0.5,b=1.5,故n(CO):n(CO2)=0.5mol:1.5mol=1:3,故C错误;
D.生成水的物质的量= ![]() mol=2.5mol,只有乙烯时,a值最大,根据H原子守恒可知,a的极大值为:
mol=2.5mol,只有乙烯时,a值最大,根据H原子守恒可知,a的极大值为: ![]() =
= ![]() mol,只有乙烷时,a值最小,根据H原子守恒可知,a的极小值为:
mol,只有乙烷时,a值最小,根据H原子守恒可知,a的极小值为: ![]() =
= ![]() mol,故a的取值范围为:
mol,故a的取值范围为: ![]() <a<
<a< ![]() ,故D正确;
,故D正确;
故选C.


科目:高中化学 来源: 题型:
【题目】用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如图),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内的液面上升,气体变成无色;③滴管内的液面再次下降。下列说法中不正确的是( )
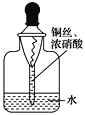
A. 现象①中产生的红棕色气体为NO2
B. 产生现象②的原因是NO2与水反应
C. 产生现象③的原因是铜与稀硝酸反应
D. 最终瓶内溶液中的溶质一定只有Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语能正确表示相应意义的是( )
A.乙烯的结构简式C2H4
B.丁烷的结构简式CH3(CH2)2CH3
C.四氯化碳的结构式 ![]()
D.苯的分子式 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁粉是制造焰火的原料之一,工业上镁粉是通过将镁粉蒸气冷却得到的.下列气体中,可用作冷却镁粉的保护气的是( )
A.空气
B.二氧化碳
C.氧气
D.氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个试管中,发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
试管 | 盐酸浓度 | 温度 | 锌的状态 |
A | 0.5molL﹣1 | 20℃ | 块 状 |
B | 0.5molL﹣1 | 20℃ | 粉末状 |
C | 2molL﹣1 | 35℃ | 块 状 |
D | 2molL﹣1 | 35℃ | 粉末状 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填入对应的空格中.
实验目的 | 实验方法 |
证明地瓜粉中有淀粉 | |
检验酒精中是否含有水 | |
证明NaOH溶液呈碱性 | |
除去FeCl2溶液中少量的FeCl3 |
实验方法:
A.加入足量铁粉,过滤
B.碘水
C.无水硫酸铜粉末
D.滴入酚酞试液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 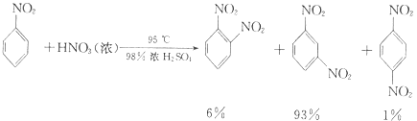
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
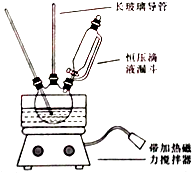
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)及其盐(如NaN3、NH4N3、CuN3等)都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)6(H3O)3(NH4)4Cl。回答下列问题:
(1)PHAC中“N3”的化合价为______。N2F2的电子式为_______。
(2)汽车安全气囊中的NaN3可发生下列反应:
NaN3(s)=Na(s)+3/2N2(g) △H1;
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H1;
则反应CuO(s)+2Na(s)=Na2O(s)+Cu(s) △H=_______(用△H1和△H2表示)
(3)25℃时,将lmolNH4N3投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol, 则NH4N3的平衡转化率为_______,25℃时该反应的平衡常数K=________。
(4)氢叠氮酸(HN3)易溶于水,且酸性与醋酸相近。
①HN3在水溶液中的电离方程式为_______________.
② 0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合,混合溶液中各离子浓度由大到小的顺序为__________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq)![]() 2CuN3(s)+S2-(aq)的平衡常数K=_________.
2CuN3(s)+S2-(aq)的平衡常数K=_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com