
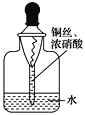
【题目】用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如图),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内的液面上升,气体变成无色;③滴管内的液面再次下降。下列说法中不正确的是( )
A. 现象①中产生的红棕色气体为NO2
B. 产生现象②的原因是NO2与水反应
C. 产生现象③的原因是铜与稀硝酸反应
D. 最终瓶内溶液中的溶质一定只有Cu(NO3)2
【答案】D
【解析】试题分析:A.用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中,铜和浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的二氧化氮为红棕色气体,因滴管内有气体生成,压强增大,所以,液面下降,现象①中产生的红棕色气体为NO2,正确;B.现象①中产生的二氧化氮能和水反应,N元素的化合价既升高又降低,N元素的化合价由+4升高到+5价,降低到+2价,反应为:3NO2+H2O═2HNO3 +NO,从方程式可知,3mol红棕色的二氧化氮与水反应,生成1mol一氧化氮无色气体,气体体积减少,滴管内压强减少,所以滴管内液面上升,气体变成无色,正确;C.现象②3NO2+H2O═2HNO3 +NO,生成的硝酸与内置的螺旋状铜丝反应,3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,因滴管内有气体生成,压强增大,所以,液面下降,所以产生现象③的原因是铜与稀硝酸反应,正确;D.滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,现象③3Cu+8HNO3(稀)= 2Cu(NO3)2+2NO↑+4H2O,生成的一氧化氮气体与氧气反应生成硝酸,硝酸继续与铜反应,最终可能有硝酸剩余,所以最终瓶内溶液中的溶质一定有Cu(NO3)2,可能有硝酸,错误。


科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2+O22SO3 , 下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强
B.升高温度
C.使用催化剂
D.多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应X(g)+3Y(g)2Z(g)△H=﹣92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( ) 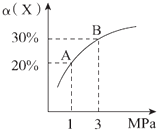
A.图中A,B两点,达到相同的平衡体系
B.上述反应在达到平衡后,增大压强,H2的转化率提高
C.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D.将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中:2A(g)+B(g)![]() 2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
A. 3.4 mol B. 3.2 mol C. 2.8 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g).CO和H2O(g)浓度变化如图 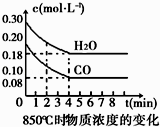
(1)0~4min的平均反应速率v(CO)=molL﹣1min﹣1 .
(2)该条件下,此反应的平衡常数K=(写表达式).
(3)该反应平衡时CO的转化率为 .
(4)能判断该反应达到化学平衡状态的依据是 . A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将 , 该反应的化学反应速率将(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①c1数值0.08molL﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 , 表中5min~6min之间数值发生变化,可能的原因是 .
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用如下图所示的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol/L的盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。


填写下列空白:
(1)进行实验时,试管A中应加入的试剂是______;烧瓶B的作用是______;烧瓶C的作用是______;在试管D中收集得到的是______(填名称)。
(2)实验时,U形管G中应加入的试剂是________;长颈漏斗H中应加入_______。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)________。
(4)试管E中发生反应的化学方程式是_____________,为了安全,在E管中反应发生前,在F出口处必须_____
(5)设计实验证明反应后A管固体中有Fe3+ ,简述必要的操作、现象_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.标准状况下,1L庚烷所含有的分子数为 ![]()
B.1mol甲基(﹣CH3)所含电子数为9NA
C.标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数为16NA
D.26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液显绿色,KMnO4溶液紫红色。
实验流程如下: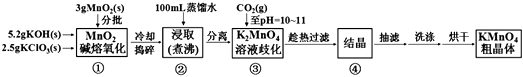
请回答:
(1)步骤①应在中熔化,并用铁棒用力搅拌,以防结块。
A.烧杯
B.蒸发皿
C.瓷坩埚
D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是。
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是。
③下列监控K2MnO4歧化完全的方法或操作可行的是。
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2 , 若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是。
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①实验时先将草酸晶体(H2C2O4·2H2O)配成标准溶液,实验室常用的容量瓶的规格有100mL、250mL等多种,现配制90mL 1.5mol·L-1的草酸溶液,需要称取草酸晶体的质量为g。[已知Mr(H2C2O4·2H2O)=126]
②量取KMnO4溶液应选用(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯与乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45g水,则下列说法错误的是( )
A.当a=1时,乙烯和乙烷的物质的量之比为1:1
B.当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 ![]() 时,则b=3
时,则b=3
C.当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 ![]() 时,则CO和CO2的物质的量之比为3:1
时,则CO和CO2的物质的量之比为3:1
D.a的取值范围为 ![]() <a<
<a< ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com