
【题目】高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液显绿色,KMnO4溶液紫红色。
实验流程如下: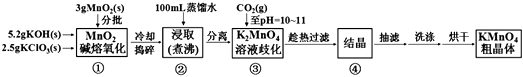
请回答:
(1)步骤①应在中熔化,并用铁棒用力搅拌,以防结块。
A.烧杯
B.蒸发皿
C.瓷坩埚
D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是。
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是。
③下列监控K2MnO4歧化完全的方法或操作可行的是。
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2 , 若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是。
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①实验时先将草酸晶体(H2C2O4·2H2O)配成标准溶液,实验室常用的容量瓶的规格有100mL、250mL等多种,现配制90mL 1.5mol·L-1的草酸溶液,需要称取草酸晶体的质量为g。[已知Mr(H2C2O4·2H2O)=126]
②量取KMnO4溶液应选用(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将(填“偏大”、“偏小”或“不变”)。
【答案】
(1)D
(2)B;CO2与K2CO3溶液反应生成KHCO3 , 结晶时会同KMnO4一起结晶析出,产品纯度降低;B
(3)温度过高,产品受热分解,温度过低,烘干时间长
(4)18.9g;酸式;偏小
【解析】 (1)熔融固体物质需要在坩埚内加热,但加热熔融物中含有碱性KOH,瓷坩埚中含有二氧化硅,二氧化硅能够与氢氧化钾反应,所以应用铁坩埚,答案选D。
(2)①A、二氧化硫具有还原性易被氧化,A错误;B、稀醋酸可以提供酸性环境,且生成的盐容易分离,B正确;C、稀盐酸易被高锰酸钾氧化为氯气,C错误;D、稀硫酸生成的 硫酸钾的溶解度与高锰酸钾相近,不容易分离,D错误,答案选B。
②根据表中数据可知碳酸氢钾的溶解度小,CO2与K2CO3溶液反应生成KHCO3,结晶时会同KMnO4一起结晶析出,产品纯度降低;
③A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,但由于紫红色会掩盖绿色,所以不能表明反应已歧化完全,A错误;B.取上层清液少许于试管中,继续通入CO2 , 根据反应原理可知若无沉淀产生,表明反应已歧化完全,B正确;C.用玻璃棒蘸取溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全,C项;D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,只能表面溶液显弱碱性,但不能表明反应已歧化完全,D错误,答案选B。
(3)由于温度过高,产品受热分解;温度过低,烘干时间长,因此烘干时,温度控制在80℃为宜。
(4)①实验时先将草酸晶体(H2C2O4·2H2O)配成标准溶液,实验室常用的容量瓶的规格有100mL、250mL等多种,现配制90mL 1.5mol·L-1的草酸溶液,则需要100mL容量瓶,因此需要称取草酸晶体的质量为0.1L×1.5mol/L×126g/mol=18.9g。
②酸性高锰酸钾溶液显酸性,具有强氧化性,因此量取KMnO4溶液应选用酸式滴定管,若该滴定管用蒸馏水洗净后未润洗,则溶液浓度被稀释,消耗标准液的体积减少,因此最终测定结果将偏小。
【考点精析】本题主要考查了直接加热的仪器及使用方法和酸碱中和滴定的相关知识点,需要掌握加热试管时,应先均匀加热后局部加热;中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如图),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内的液面上升,气体变成无色;③滴管内的液面再次下降。下列说法中不正确的是( )
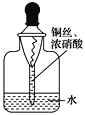
A. 现象①中产生的红棕色气体为NO2
B. 产生现象②的原因是NO2与水反应
C. 产生现象③的原因是铜与稀硝酸反应
D. 最终瓶内溶液中的溶质一定只有Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化中,需要加入适当的氧化剂才能实现的是
A. PCl3→PCl5 B. MnO4—→Mn2+ C. SO3→SO42— D. CO2→H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语能正确表示相应意义的是( )
A.乙烯的结构简式C2H4
B.丁烷的结构简式CH3(CH2)2CH3
C.四氯化碳的结构式 ![]()
D.苯的分子式 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁粉是制造焰火的原料之一,工业上镁粉是通过将镁粉蒸气冷却得到的.下列气体中,可用作冷却镁粉的保护气的是( )
A.空气
B.二氧化碳
C.氧气
D.氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 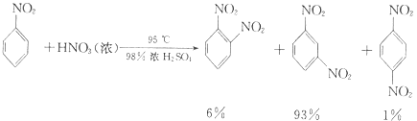
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
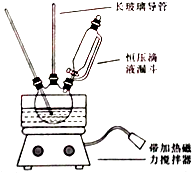
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com