
【题目】原子通过得电子或失电子形成与Ar原子相同电子层结构的是( )
A.LiB.NaC.OD.Cl
科目:高中化学 来源: 题型:
【题目】在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用如下图所示的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol/L的盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。


填写下列空白:
(1)进行实验时,试管A中应加入的试剂是______;烧瓶B的作用是______;烧瓶C的作用是______;在试管D中收集得到的是______(填名称)。
(2)实验时,U形管G中应加入的试剂是________;长颈漏斗H中应加入_______。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)________。
(4)试管E中发生反应的化学方程式是_____________,为了安全,在E管中反应发生前,在F出口处必须_____
(5)设计实验证明反应后A管固体中有Fe3+ ,简述必要的操作、现象_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃A在一定条件下可以按下图进行:
已知:CH3CH2CH2CH2CH2CH2Br ![]() CH3CH2CH2CH2CH═CH2+HBr
CH3CH2CH2CH2CH═CH2+HBr
已知D为  ,F1和F2互为同分异构体,G1和G2互为同分异构体.请填空:
,F1和F2互为同分异构体,G1和G2互为同分异构体.请填空:
(1)A的结构简式是: .
(2)框图中属于取代反应的是(填数字代号): .
(3)框图中属于加成反应的是 .
(4)G1的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液显绿色,KMnO4溶液紫红色。
实验流程如下: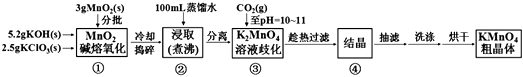
请回答:
(1)步骤①应在中熔化,并用铁棒用力搅拌,以防结块。
A.烧杯
B.蒸发皿
C.瓷坩埚
D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是。
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是。
③下列监控K2MnO4歧化完全的方法或操作可行的是。
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2 , 若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)烘干时,温度控制在80℃为宜,理由是。
(4)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①实验时先将草酸晶体(H2C2O4·2H2O)配成标准溶液,实验室常用的容量瓶的规格有100mL、250mL等多种,现配制90mL 1.5mol·L-1的草酸溶液,需要称取草酸晶体的质量为g。[已知Mr(H2C2O4·2H2O)=126]
②量取KMnO4溶液应选用(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关图中化合物的说法错误的是( ) 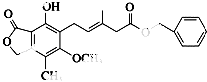
A.该化合物与Br2能发生加成反应和取代反应
B.1 mol该化合物与NaOH溶液反应时最多消耗3 mol NaOH
C.该化合物能使酸性高锰酸钾溶液褪色
D.该化合物能和Na2CO3溶液反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第族,其基态原子中未成对电子的个数为。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为 , 所含非金属元素的电负性由大到小的顺序是。
(3)尿素分子中、碳原子为杂化,分子中σ键与π键的数目之比为。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为。若晶体密度为dg·cm3 , 则晶胞中最近的两个碳原子的距离为pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。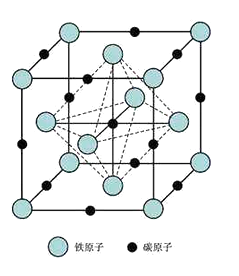
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g)PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 | 平衡物质的量 | 达到平衡所需时间 | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是( )
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)= ![]() mol/(L?s)
mol/(L?s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com