
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g)PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 | 平衡物质的量 | 达到平衡所需时间 | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是( )
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)= ![]() mol/(L?s)
mol/(L?s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
【答案】BD
【解析】解:A、平衡常数只与温度有关,温度不变,平衡常数不变,I中K= 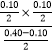 =
= ![]() ≈0.03,容器III中K=
≈0.03,容器III中K= 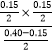 =0.045,即平衡常数K:容器Ⅱ<容器Ⅲ,故A错误;B、PCl5(g)PCl3(g)+Cl2(g),此反应正反应方向为压强增大的反应,增大压强,平衡左移,即PCl5的转化率:容器Ⅱ<容器Ⅰ,故B正确;
=0.045,即平衡常数K:容器Ⅱ<容器Ⅲ,故A错误;B、PCl5(g)PCl3(g)+Cl2(g),此反应正反应方向为压强增大的反应,增大压强,平衡左移,即PCl5的转化率:容器Ⅱ<容器Ⅰ,故B正确;
C、v(Cl2)= ![]() =v(PCl5),故C错误;
=v(PCl5),故C错误;
D、由Ⅲ得出此时K= 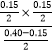 =0.09,起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则此时Qc=
=0.09,起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则此时Qc=  =0.075,由于Qc<0.09,故平衡左移,故D正确,故选BD.
=0.075,由于Qc<0.09,故平衡左移,故D正确,故选BD.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).


科目:高中化学 来源: 题型:
【题目】为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填入对应的空格中.
实验目的 | 实验方法 |
证明地瓜粉中有淀粉 | |
检验酒精中是否含有水 | |
证明NaOH溶液呈碱性 | |
除去FeCl2溶液中少量的FeCl3 |
实验方法:
A.加入足量铁粉,过滤
B.碘水
C.无水硫酸铜粉末
D.滴入酚酞试液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生甲设计了如下装置以验证亚硫酸与次氯酸的酸性强弱:H2SO3>HCl0。
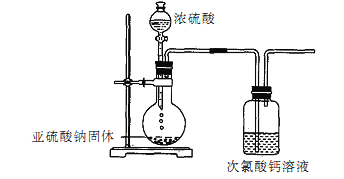
(1)甲得出结论的现象________________。
(2)学生乙对甲的实验结论提出了质疑,乙的理由是:____,随后对装置做了如下改进。

X、Y、Z是选用了下列部分试剂:饱和NaHC03溶液、品红溶液、NaOH溶液,乙得出结论的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 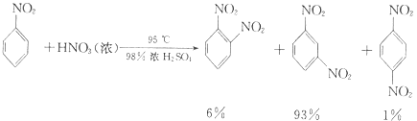
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
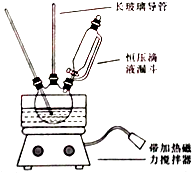
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂.氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙在一定条件下与氧气反应生成的产物不只一种.氢化钙通常用氢气与金属钙加热制取,如图1是模拟制取装置. 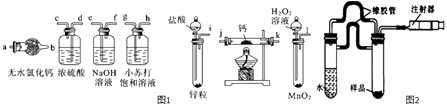
请回答下列问题:
(1)利用上述装置制取氢化钙时按气流方向连接顺序为(填仪器接口的字母编号).
i→→→→→→→a
(2)装有无水氯化钙装置的作用是 .
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(4)甲同学设计了一个实验,测定上述实验中得到的氢化钙的纯度.请完善下列实验步骤:
①样品称量;
②加入溶液(填化学式),搅拌;
③(填操作名称);洗涤;干燥
④称量碳酸钙.
(5)利用上述题目中给出的装置(试剂可另选)设计实验,用化学方法证明产物中含有氢化钙,写出实验简要步骤及观察到的现象 .
(6)乙同学利用图2所示装置测定上述实验中得到的氢化钙的纯度.他称取46mg所制得的氢化钙样品,记录开始时注射器活栓停留在lO.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定).试通过计算求样品中氢化钙的纯度: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L1·min1,则以物质B表示此反应的化学反应速率为________mol·L1·min1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为____________________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) ![]() 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
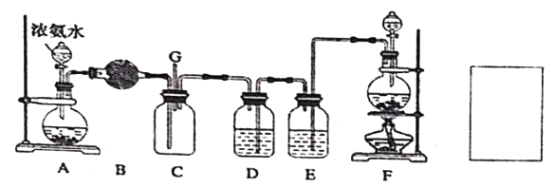
(1)装置F 为实验室制备氯气的装置,请写出实验室制备氯气的化学方程式________;
(2)装置A 中烧瓶内的固体可选用_____;装置B 中试剂可选用_____;
a.碱石灰 b.无水CuSO4 c.无水CaCl2 d.浓硫酸
(3)E 装置选用试剂的名称_____;
(4)装置C 内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
①请写出反应的化学方程式______________;
②并用单线桥表示电子转移的方向和数目。
③当有amol氯气参加反应时,转移的电子总数为b 个,则阿伏加德罗数常数表示为______________;(用含a、b 的代数式表示,结果注明单位)
(5)通入C 装置的两根导管左边较长、右边较短,目的是______________;从装置C 的G 处逸出的尾气中可能含有黄绿色的有毒气体,请在上图右边方框中画图,表示处理该气体的方法,并标出气流方向和所用试剂的名称。_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com