
【题目】现有溶质为HCl、NaCl、NaOH和Cl2四种溶液,可区别它们的一种试剂
A.AgNO3溶液B.酚酞溶液C.紫色石蕊溶液D.饱和食盐水
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g)PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 | 平衡物质的量 | 达到平衡所需时间 | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是( )
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)= ![]() mol/(L?s)
mol/(L?s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据电解质溶液的知识,回答下列问题:
已知0.1mol·L-1的NaHSO4溶液中H+的浓度为0.1mol·L-1,
(1)写出NaHSO4在水溶液中的电离方程式:________________________________________。
(2)若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,离子方程式为_______________。
(3)若向Ba(OH)2溶液中滴加NaHSO4溶液至溶液恰好呈中性,反应的离子方程式为___。
(4)向NaAlO2中滴加NaHSO4溶液,现象为:________________;请你用离子方程式解释产生上述现象的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒或物质: A、O2和O3
B、 ![]() 和
和 ![]()
C、CH3CH2CH2CH3和 ![]()
D、 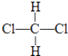 和
和 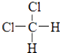
E、CH3CH2CH2CH3和 ![]()
(i)组两种微粒互为同位素;
(ii)组两种物质互为同素异形体;
(iii)组两种物质属于烃;
(iv)组两物质互为同分异构体;
(v)组两物质是同一物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH3CH3+Cl2 ![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
B.CH2═CH2+HBr→CH3CH2Br
C.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH ![]() H3COOCH2CH3+H2O
H3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿( 主要成分MnO2)制高锰酸钾的流程如下(部分条件和产物省略):
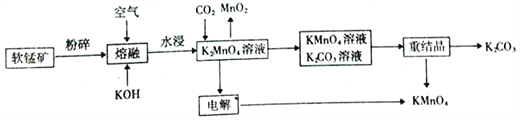
请回答下列问题:
(1)在“水浸”过程中,提高K2MnO4浸出率(浸出的K2MnO4质量与“熔块”质量之比)的措施有_______( 至少写出两点)。
(2)“熔融”过程中发生反应的化学方程式为___________。
(3)CO2 与K2MnO4反应的离子方程式为___________。
(4)“电解”过程中使用的是惰性电极,则:
①阳极反应的方程式为__________。
②阴极附近溶液的pH将__________。(填“增大”“减小” 或“ 不变”)。
(5)在上述过程中产生的Mn2+会对环境造成污染。工业上,通过调节pH使废水中的Mn2+形成Mn(OH)2 沉淀。当pH=10时,溶液中的c(Mn2+)=______(已知:Ksp[Mn(OH)2]=2.0×10-13。相关数据均在常温下测定)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是( )
A.水的离子积KW只与温度有关,但水的电离程度一定会受外加酸、碱、盐的影响
B.若HA的Ka=1.7×10﹣5 , BOH的Kb=1.7×10﹣5 , 则HA溶液中的c(H+)与BOH中的c(OH﹣)相等
C.将0.2mol/L HA溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH﹣)+c(A﹣)=c(H+)+c(HA)
D.Mg(OH)2能溶于NH4Cl浓溶液的主要原因是NH4+结合OH﹣使沉淀溶解平衡发生正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1 ,
请写出Cu2S与O2反应生成Cu与SO2的热反应方程式: .
(2)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl﹣) 的关系如图1.①当c(Cl﹣)=9molL﹣1时,溶液中主要的3种含铜物种浓度大小关系为 . 
②在c(Cl﹣)=1molL﹣1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为(任写一个).
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图2
(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)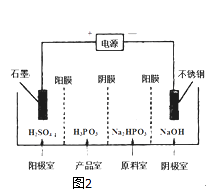
①阳极的电极反应式为: .
②产品室中反应的离子方程式为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com