
【题目】某学生利用以下装置探究氯气与氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
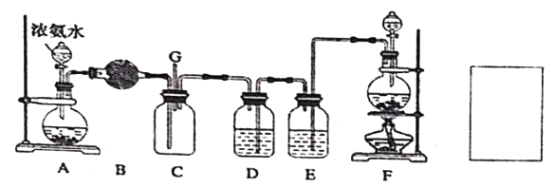
(1)装置F 为实验室制备氯气的装置,请写出实验室制备氯气的化学方程式________;
(2)装置A 中烧瓶内的固体可选用_____;装置B 中试剂可选用_____;
a.碱石灰 b.无水CuSO4 c.无水CaCl2 d.浓硫酸
(3)E 装置选用试剂的名称_____;
(4)装置C 内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
①请写出反应的化学方程式______________;
②并用单线桥表示电子转移的方向和数目。
③当有amol氯气参加反应时,转移的电子总数为b 个,则阿伏加德罗数常数表示为______________;(用含a、b 的代数式表示,结果注明单位)
(5)通入C 装置的两根导管左边较长、右边较短,目的是______________;从装置C 的G 处逸出的尾气中可能含有黄绿色的有毒气体,请在上图右边方框中画图,表示处理该气体的方法,并标出气流方向和所用试剂的名称。_____________
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O a a 饱和食盐水
MnCl2+Cl2↑+2H2O a a 饱和食盐水 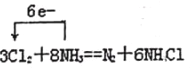 b/2a mol-1 使密度大的氯气与密度小的氨气较快地均匀混合
b/2a mol-1 使密度大的氯气与密度小的氨气较快地均匀混合 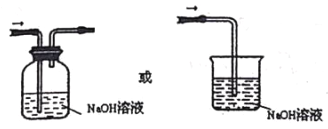
【解析】(1)氯气的实验室制备方法:浓盐酸和二氧化锰在加热条件下发生反应来制取,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)将浓氨水滴加到生石灰或碱石灰或固体氢氧化钠上可以产生氨气,所以装置A的烧瓶中可装试剂是生石灰或碱石灰或固体氢氧化钠,答案选a;装置B中试剂用来干燥氨气,氨气能与氯化钙或浓硫酸反应,可选用碱石灰作干燥剂,无水CuSO4一般用来检验水蒸气的存在,一般不作干燥剂,答案选a;(3)E装置中的饱和食盐水可以将氯气中的氯化氢吸收,氯气不溶于其中,但是氯化氢在其中的溶解度较大,因此E装置选用试剂的名称为饱和食盐水;(4)①装置C内出现浓厚的白烟并在容器内壁凝结,生成物是氯化铵。另一生成物是空气的主要成分之一,应该为氮气,反应的化学方程式为3Cl2+8NH3=N2+6NH4Cl;②反应中氯气是氧化剂,3mol氯气得到6mol电子,因此用单线桥表示电子转移的方向和数目为
MnCl2+Cl2↑+2H2O;(2)将浓氨水滴加到生石灰或碱石灰或固体氢氧化钠上可以产生氨气,所以装置A的烧瓶中可装试剂是生石灰或碱石灰或固体氢氧化钠,答案选a;装置B中试剂用来干燥氨气,氨气能与氯化钙或浓硫酸反应,可选用碱石灰作干燥剂,无水CuSO4一般用来检验水蒸气的存在,一般不作干燥剂,答案选a;(3)E装置中的饱和食盐水可以将氯气中的氯化氢吸收,氯气不溶于其中,但是氯化氢在其中的溶解度较大,因此E装置选用试剂的名称为饱和食盐水;(4)①装置C内出现浓厚的白烟并在容器内壁凝结,生成物是氯化铵。另一生成物是空气的主要成分之一,应该为氮气,反应的化学方程式为3Cl2+8NH3=N2+6NH4Cl;②反应中氯气是氧化剂,3mol氯气得到6mol电子,因此用单线桥表示电子转移的方向和数目为 。③当有3mol氯气参加反应时,转移的电子为6mol,当有a mol氯气参加反应时,转移的电子为2a mol,个数是b=2amolNA,所以NA=b/2a mol-1;(5)氨气密度比氯气的小,通入C装置的两根导管左边较长(导氨气)、右边较短(导氯气),可以保证二者充分混合;氯气是大气污染物,可以用氢氧化钠溶液吸收,装置图为
。③当有3mol氯气参加反应时,转移的电子为6mol,当有a mol氯气参加反应时,转移的电子为2a mol,个数是b=2amolNA,所以NA=b/2a mol-1;(5)氨气密度比氯气的小,通入C装置的两根导管左边较长(导氨气)、右边较短(导氯气),可以保证二者充分混合;氯气是大气污染物,可以用氢氧化钠溶液吸收,装置图为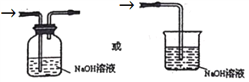 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第族,其基态原子中未成对电子的个数为。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为 , 所含非金属元素的电负性由大到小的顺序是。
(3)尿素分子中、碳原子为杂化,分子中σ键与π键的数目之比为。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为。若晶体密度为dg·cm3 , 则晶胞中最近的两个碳原子的距离为pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。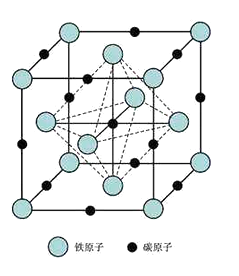
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g)PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 | 平衡物质的量 | 达到平衡所需时间 | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是( )
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)= ![]() mol/(L?s)
mol/(L?s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用金属钠或者金属钾
B.利用质谱法
C.利用红外光谱法
D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各条件下可能共存的离子组是( )
A. 某无色溶液中: ![]() 、Na+、Cl-、
、Na+、Cl-、![]()
B. 由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、![]() 、
、![]()
C. 在c(H+)=1×10-13 mol·L-1的溶液中: ![]() 、Al3+、
、Al3+、![]() 、
、![]()
D. 在pH=1的溶液中:K+、Fe2+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不属于同分异构体的是( )
A.2,2﹣二甲基丙醇和2﹣甲基丁醇
B.甲基丙烯酸和甲酸丙酯
C.2﹣甲基丁烷和戊烷
D.邻氯甲苯和对氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据电解质溶液的知识,回答下列问题:
已知0.1mol·L-1的NaHSO4溶液中H+的浓度为0.1mol·L-1,
(1)写出NaHSO4在水溶液中的电离方程式:________________________________________。
(2)若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,离子方程式为_______________。
(3)若向Ba(OH)2溶液中滴加NaHSO4溶液至溶液恰好呈中性,反应的离子方程式为___。
(4)向NaAlO2中滴加NaHSO4溶液,现象为:________________;请你用离子方程式解释产生上述现象的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒或物质: A、O2和O3
B、 ![]() 和
和 ![]()
C、CH3CH2CH2CH3和 ![]()
D、 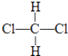 和
和 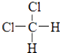
E、CH3CH2CH2CH3和 ![]()
(i)组两种微粒互为同位素;
(ii)组两种物质互为同素异形体;
(iii)组两种物质属于烃;
(iv)组两物质互为同分异构体;
(v)组两物质是同一物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是( )
A.水的离子积KW只与温度有关,但水的电离程度一定会受外加酸、碱、盐的影响
B.若HA的Ka=1.7×10﹣5 , BOH的Kb=1.7×10﹣5 , 则HA溶液中的c(H+)与BOH中的c(OH﹣)相等
C.将0.2mol/L HA溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH﹣)+c(A﹣)=c(H+)+c(HA)
D.Mg(OH)2能溶于NH4Cl浓溶液的主要原因是NH4+结合OH﹣使沉淀溶解平衡发生正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com