
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第族,其基态原子中未成对电子的个数为。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为 , 所含非金属元素的电负性由大到小的顺序是。
(3)尿素分子中、碳原子为杂化,分子中σ键与π键的数目之比为。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为。若晶体密度为dg·cm3 , 则晶胞中最近的两个碳原子的距离为pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。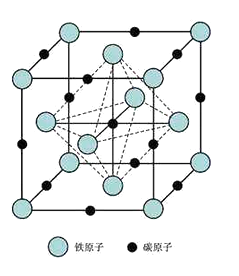
【答案】
(1)Ⅷ;3
(2)1s22s22p63s23p63d64s2;O、N、C、H
(3)sp2;7∶1
(4)离子半径大小
(5)SO42-、NH3
(6)FeC;![]() ×3
×3 ![]() ×1010
×1010
【解析】(1)钴的核电荷数为27,位于元素周期表的第四周期第Ⅷ 族,其基态原子的电子排布式为[Ar]3d74s2 , 可知未成对电子的个数为3;
(2)基态Fe的电子排布式为1s22s22p63s23p63d64s2 , 则Fe3+的核外电子排布式为1s22s22p63s23p63d5(或[Ar]3d5),通常元素的非金属性越大,电负性越大,则所含非金属元素C、N、O、H中O的非金属性最强,H最弱,四者的电负性由大到小的顺序是O、N、C、H;
(3)由尿素分子的结构式 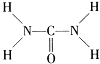 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化;分子中σ键数目为7,π键的数目为1,二者数目之比为7∶1;
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化;分子中σ键数目为7,π键的数目为1,二者数目之比为7∶1;
(4)晶格能的主要影响因素是离子电荷、离子半径及离子构型,FeO与NaCl的晶体构型相似,离子电荷电荷也已知,还需要离子半径大小才能比较晶格能大小;
(5)由[Co(NH3)5Br]SO4可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀;另一种加入AgNO3溶液时,会产生淡黄色沉淀溴化银,说明溴离子为配合物的外界,则第二种配合物为[Co(SO4)(NH3)5]Br,其配体为SO42-、NH3;
(6)晶胞中Fe原子的个数为8× ![]() +6×
+6× ![]() =4,碳原子数为4,Fe和C的原子数目比为1:1,则该物质的化学式为FeC;一个晶胞中含有4个FeC,设晶胞中最近的两个碳原子的距离为xcm,则晶胞的边长为
=4,碳原子数为4,Fe和C的原子数目比为1:1,则该物质的化学式为FeC;一个晶胞中含有4个FeC,设晶胞中最近的两个碳原子的距离为xcm,则晶胞的边长为 ![]() xcm,晶胞的体积为(
xcm,晶胞的体积为( ![]() x)3cm3 , 晶胞的密度为dg·cm-3=(68×4g)÷[(
x)3cm3 , 晶胞的密度为dg·cm-3=(68×4g)÷[( ![]() x)3cm3×NA],解得x=
x)3cm3×NA],解得x= ![]() cm=
cm= ![]() ×1010pm。(1)根据钴的电子排布式判断未成对电子的个数;
×1010pm。(1)根据钴的电子排布式判断未成对电子的个数;
(2)根据基态铁原子的电子排布式,书写三价铁离子的电子排布;结合非金属性判断电负性的强弱;
(3)根据尿素的结构式判断碳原子的杂化方式;
(4)根据晶格能的影响因素进行判断;
(5)根据络合物的组成判断配体即可;
(6)根据均摊法确定化学式,结合密度的计算得出边长即可。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3![]()
B. (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH===Fe(OH)2↓
C. 向NaAlO2溶液中通入过量的CO2:2AlO![]() +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO![]()
D. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+===Fe2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁粉是制造焰火的原料之一,工业上镁粉是通过将镁粉蒸气冷却得到的.下列气体中,可用作冷却镁粉的保护气的是( )
A.空气
B.二氧化碳
C.氧气
D.氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25.0mL 0.200 mol·L-1的Na2S2O3溶液恰好把448mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化为( )
A. S2- B. S C. SO32- D. SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填入对应的空格中.
实验目的 | 实验方法 |
证明地瓜粉中有淀粉 | |
检验酒精中是否含有水 | |
证明NaOH溶液呈碱性 | |
除去FeCl2溶液中少量的FeCl3 |
实验方法:
A.加入足量铁粉,过滤
B.碘水
C.无水硫酸铜粉末
D.滴入酚酞试液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生甲设计了如下装置以验证亚硫酸与次氯酸的酸性强弱:H2SO3>HCl0。
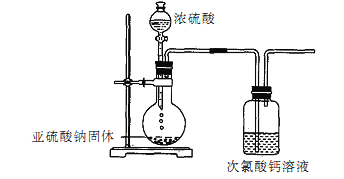
(1)甲得出结论的现象________________。
(2)学生乙对甲的实验结论提出了质疑,乙的理由是:____,随后对装置做了如下改进。

X、Y、Z是选用了下列部分试剂:饱和NaHC03溶液、品红溶液、NaOH溶液,乙得出结论的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
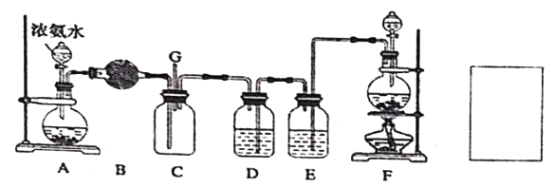
(1)装置F 为实验室制备氯气的装置,请写出实验室制备氯气的化学方程式________;
(2)装置A 中烧瓶内的固体可选用_____;装置B 中试剂可选用_____;
a.碱石灰 b.无水CuSO4 c.无水CaCl2 d.浓硫酸
(3)E 装置选用试剂的名称_____;
(4)装置C 内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
①请写出反应的化学方程式______________;
②并用单线桥表示电子转移的方向和数目。
③当有amol氯气参加反应时,转移的电子总数为b 个,则阿伏加德罗数常数表示为______________;(用含a、b 的代数式表示,结果注明单位)
(5)通入C 装置的两根导管左边较长、右边较短,目的是______________;从装置C 的G 处逸出的尾气中可能含有黄绿色的有毒气体,请在上图右边方框中画图,表示处理该气体的方法,并标出气流方向和所用试剂的名称。_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com