
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA
B.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣数目为0.2NA
C.标准状况下,22.4LCHCl3含有的分子数为NA
D.1L 0.1molL﹣1的硫化钠溶液中硫离子数目为0.1NA
【答案】A
【解析】 解:A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,1mol氯气参加反应转移1mol电子,则0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA , 故A正确;
B.pH=13,即C(H+)=10﹣13mol/L,C(OH﹣)= ![]() mol/L=0.1mol/L,根据n=CV=0.1mol/L×1.0L=0.1mol,个数为NA个,故B错误;
mol/L=0.1mol/L,根据n=CV=0.1mol/L×1.0L=0.1mol,个数为NA个,故B错误;
C.标况下,CHCl3为液体,不能使用气体摩尔体积,故C错误;
D.硫离子为多元弱碱离子,水溶液中部分水解,所以1L 0.1molL﹣1的硫化钠溶液中硫离子数目小于0.1NA , 故D错误;
故选:A.


科目:高中化学 来源: 题型:
【题目】下列各条件下可能共存的离子组是( )
A. 某无色溶液中: ![]() 、Na+、Cl-、
、Na+、Cl-、![]()
B. 由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、![]() 、
、![]()
C. 在c(H+)=1×10-13 mol·L-1的溶液中: ![]() 、Al3+、
、Al3+、![]() 、
、![]()
D. 在pH=1的溶液中:K+、Fe2+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿( 主要成分MnO2)制高锰酸钾的流程如下(部分条件和产物省略):
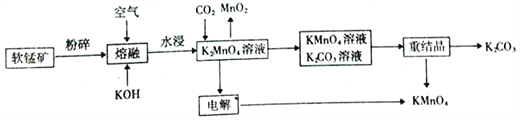
请回答下列问题:
(1)在“水浸”过程中,提高K2MnO4浸出率(浸出的K2MnO4质量与“熔块”质量之比)的措施有_______( 至少写出两点)。
(2)“熔融”过程中发生反应的化学方程式为___________。
(3)CO2 与K2MnO4反应的离子方程式为___________。
(4)“电解”过程中使用的是惰性电极,则:
①阳极反应的方程式为__________。
②阴极附近溶液的pH将__________。(填“增大”“减小” 或“ 不变”)。
(5)在上述过程中产生的Mn2+会对环境造成污染。工业上,通过调节pH使废水中的Mn2+形成Mn(OH)2 沉淀。当pH=10时,溶液中的c(Mn2+)=______(已知:Ksp[Mn(OH)2]=2.0×10-13。相关数据均在常温下测定)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是( )
A.水的离子积KW只与温度有关,但水的电离程度一定会受外加酸、碱、盐的影响
B.若HA的Ka=1.7×10﹣5 , BOH的Kb=1.7×10﹣5 , 则HA溶液中的c(H+)与BOH中的c(OH﹣)相等
C.将0.2mol/L HA溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH﹣)+c(A﹣)=c(H+)+c(HA)
D.Mg(OH)2能溶于NH4Cl浓溶液的主要原因是NH4+结合OH﹣使沉淀溶解平衡发生正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
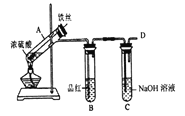
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘具有多种放射性同位素. ![]() I俗称“碘131”,广泛地用于医学诊断作为追踪剂和甲状腺内分泌失调症的治疗.下列有关
I俗称“碘131”,广泛地用于医学诊断作为追踪剂和甲状腺内分泌失调症的治疗.下列有关 ![]() I叙述正确的是( )
I叙述正确的是( )
A.碘元素的相对原子质量为131
B.![]() I是一种新发现的碘的核素
I是一种新发现的碘的核素
C.![]() I位于元素周期表中第4周期ⅦA族
I位于元素周期表中第4周期ⅦA族
D.![]() I核内的中子数与核外电子数之差为29
I核内的中子数与核外电子数之差为29
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com