
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 不溶于水和稀硫酸,制取流程如下:

请回答下列问题:
(1)溶液X是_______。
(2)在黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 中,x、y、z的代数关系式为_______。
(3)检验滤液中是否存 在K+的操作是_______。
(4)黄钾铵铁矾的化学式可通过下列实验测定:
步骤1: 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶配制成100.00mL 溶液A。
步骤2: 最取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g。
步骤3: 量取25.00mL溶液A,加入足最NaOH溶液,加热,收集到标准状下气体224mL,同时有红褐色沉淀生成。
步骤4: 将步骤3所得沉淀过滤、洗涤、灼烧,最终得固体4.80g。
①步骤1配制溶液A所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需_______。
②根据以上实验数据计算黄钾铵铁矾中的n(OH-)∶n(SO42-)的比值为_______。(写出必要的计算过程,否则不得分)
【答案】 氨水(或写"NH3·H2O") 3x+2=2y+z 用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,若火焰呈紫色,则存在K+。(没有写“蓝色钴玻璃”不扣分) 100mL容量瓶 n(SO42-)=n(BaSO4)= ![]() =0.04 mol,n(NH4+) =n(NH3) =
=0.04 mol,n(NH4+) =n(NH3) =![]() =0.01mol,n(Fe3+)= 2n(Fe2O3)= 2×
=0.01mol,n(Fe3+)= 2n(Fe2O3)= 2×![]() = 0.06 mol,n(K+)=n(NH4+)=0.01mol ,根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12mol,n(OH-) ∶n(SO42-)=3∶1
= 0.06 mol,n(K+)=n(NH4+)=0.01mol ,根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12mol,n(OH-) ∶n(SO42-)=3∶1
【解析】(1)根据最终产物的组成成分中含有NH4+和OH-,而已知原料K2SO4和Fe2(SO4)3中没有,所以溶液X为氨水;
(2)根据黄钾铵铁矾的分子组成KNH4Fex(SO4)y(OH)z,结合化合价规则即得x、y、z的代数关系式为3x+2=2y+z;
(3)K+的检验只有用焰色反应,其操作是用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,若火焰呈紫色,则存在K+;
(4)① 步骤1配制溶液A所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需100mL容量瓶;②根据操作步骤分析可知,加入盐酸酸化的BaCl2溶液生成9.32g白色固体为BaSO4,即n(BaSO4)=n(SO42-)= ![]() = 0.04mol,加入足最NaOH溶液,加热,收集到标准状下气体224mL为NH3,即n(NH4+)=n(NH3)=
= 0.04mol,加入足最NaOH溶液,加热,收集到标准状下气体224mL为NH3,即n(NH4+)=n(NH3)=![]() =0.01mol,生成红褐色沉淀为Fe(OH)3,经洗涤、灼烧,最终得固体4.80g为Fe2O3,所以有n(Fe3+)=2n(Fe2O3) = 2×
=0.01mol,生成红褐色沉淀为Fe(OH)3,经洗涤、灼烧,最终得固体4.80g为Fe2O3,所以有n(Fe3+)=2n(Fe2O3) = 2×![]() =0.06mol,由该物质的化学式可知n(K+)=n(NH4+)=0.01mol,再根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12mol,所以n(OH-)∶n(SO42-)=0.12mol∶0.04mol=3∶1。
=0.06mol,由该物质的化学式可知n(K+)=n(NH4+)=0.01mol,再根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12mol,所以n(OH-)∶n(SO42-)=0.12mol∶0.04mol=3∶1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义.
(1)298K,101KPa时,在1L水中可溶解0.09mol氯气,实验测得溶于说的氯气约有 ![]() 与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
(2)用水稀释0.1mol/L氨水,溶液中随着水量的增加而增大的是(填字母)
a.c(OH﹣) b.c(NH3H2O) c.c(NH4+)c(OH﹣)
d.NH3H2O的电离程度 e.溶液的导电性
当溶液适当升高温度(不考虑NH3H2O分解和NH3逸出),上述数据增大的是;在溶液中加入少量NH4Cl固体(不考虑溶液温度变化),上述数据增大的是;当加入少量NaOH固体(不考虑溶液温度变化),上述数据增大的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为CO(g)+2H2(g) ![]() CH3OH(g) △H=-99kJ/mol。
CH3OH(g) △H=-99kJ/mol。
(1)关于该反应的下列说法,错误的是___________。
A.消耗CO和消耗CH3OH的速率相等时,说明该反应达到平衡状态
B.升高温度,正反应速率减小,逆反应速率增大
C.使用催化剂,可以提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(2)在某温度时,将1.0mol CO 与2.0 mol H2充入2 L的空钢瓶中,发生上述反应,在第5 min时达到化学平衡状态,此时甲醇的物质的量分数为10%。甲醇浓度的变化状况如图所示:

①从反应开始到5 min 时,生成甲醇的平均速率为________。
②5 min 时达到平衡,H2的平衡转化率α=_____%.化学平衡常数K= _______。
③1min 时的v正(CH3OH)______ 4min 时v逆(CH3OH ) (填“大于“小于“或“等于”)。
④若将钢瓶换成同容积的绝热钢瓶,重复上述实验,平衡时甲醇的物质的量分数_____0.1(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于吸热反应的是( )
A.甲烷在空气中燃烧
B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H2O与NH4Cl反应
D.锌粒与稀H2SO4反应制取H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
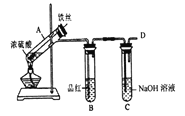
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类排列,正确的是( )
A. 硫酸 纯碱 硫酸钙 B. 盐酸 烧碱 硫酸亚铁
C. 碳酸 乙醇 烧碱 D. 磷酸 熟石灰 苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式H+ + OH-= H2O可表示的化学方程式是( )
A. 盐酸与氢氧化铜的反应 B. 硫酸氢钠与氢氧化钠的反应
C. 硫酸与氢氧化镁的反应 D. 盐酸与氨水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸(H2FeCO4)是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)Na2FeO4中Fe的化合价为______________________。.
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为__________________。
(3)在工业上制备Na2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:
2FeSO4+6Na2O2=aNa2FeO4+M↑+2Na2O+2Na2SO4
①a=_____________。
②每生成1mol M,该反应转移电子的物质的量为_________mol。
Ⅱ.湿法制备的工艺流程如下:

己知:Na2FeO4在强碱性溶液中的溶解度较小。
③反应a中,生成物除了Na2FeO4外,另一种盐的化学式为 _____________。
④一系列操作包括过滤、___________、_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com