
【题目】将下列物质按酸、碱、盐分类排列,正确的是( )
A. 硫酸 纯碱 硫酸钙 B. 盐酸 烧碱 硫酸亚铁
C. 碳酸 乙醇 烧碱 D. 磷酸 熟石灰 苛性钠
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是 ( )
A.①AgNO3;②NaBr;③AgBr B.①AgNO3;②NaCl;③AgCl
C.①AgCl; ②AgNO3;③NaCl D.①AgNO3;②NaCl;③Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 不溶于水和稀硫酸,制取流程如下:

请回答下列问题:
(1)溶液X是_______。
(2)在黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 中,x、y、z的代数关系式为_______。
(3)检验滤液中是否存 在K+的操作是_______。
(4)黄钾铵铁矾的化学式可通过下列实验测定:
步骤1: 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶配制成100.00mL 溶液A。
步骤2: 最取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g。
步骤3: 量取25.00mL溶液A,加入足最NaOH溶液,加热,收集到标准状下气体224mL,同时有红褐色沉淀生成。
步骤4: 将步骤3所得沉淀过滤、洗涤、灼烧,最终得固体4.80g。
①步骤1配制溶液A所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需_______。
②根据以上实验数据计算黄钾铵铁矾中的n(OH-)∶n(SO42-)的比值为_______。(写出必要的计算过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况.达到平衡后,改变压强,平衡不移动.下列说法中正确的是( ) 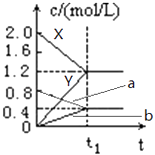
A.Z物质的变化情况为曲线b
B.该反应的化学方程式为:2X(g)3Y(g)+Z(g)
C.0→t1 , X的物质的量浓度变化量为1.2mol/L
D.若t1=1min,则v(Y )=0.02molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下:
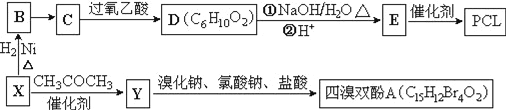
已知:①X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]() 。
。
②![]() 。
。
③RCOCH2R′![]() RCOOCH2R′。
RCOOCH2R′。
(1)B的名称是_________________。
(2)B→C还需要的反应试剂及条件是___________。C→D的反应类型是______________________。
(3)写出X→Y的化学方程式:_______________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗__molNaOH。
(5)符合以下条件的D的同分异构体有__种(不考虑空间异构)。
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:
![]()
利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图:________________________________。
,写出合成该涂料的反应流程图:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中因含有机物而具有较高的化学耗氧量.常用酸性KMnO4氧化有机物测其含量.主要操作步骤如下: 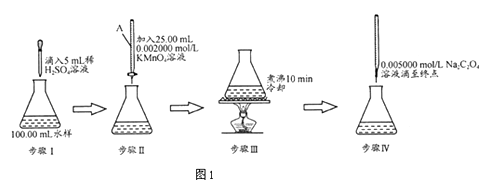
(1)仪器A为(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为;
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42﹣+MnO4﹣+H+═Mn2++CO2↑+;
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面. 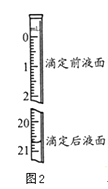
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl﹣影响
猜想2:配制Na2C2O4标液定容时;
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl﹣影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) .
资料卡片:
①有机质可HNO3被氧化
②AgCl不与酸性KMnO4溶液反应
③Ag2C2O4可被酸性KMnO4溶液氧化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)水的净化和软化的区别是水的净化是用混凝剂将水中的胶体及悬浮物沉淀下来,而水的软化是;
(2)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是;
(3)下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是(填字母).
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
(4)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4其工艺流程如下: ![]()
①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾.请解释这一做法的原因(用必要的离子方程式和文字描述).
②写出由Fe(0H)3制取Na2FeO4的化学方程式;
(5)石灰纯碱法是常用的硬水软化方法,已知25℃时Ksp(CaCO3)=2.8×10﹣9 , 现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10﹣5molL﹣1 , 则生成沉淀所需Ca(0H)2溶液的最小浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生反应是2Cu+═Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是(填“氧化剂”或“还原剂”).
(2)写出CuH在氯气中燃烧的化学反应方程式 .
(3)CuH溶液在稀盐酸中生成的气体是(填化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com