
【题目】“千年大计、国家大事”,雄安新区无疑是今年最受瞩目的地区。不过,近日媒体报道河北廊坊、天津等地存在超大规模的工业污水渗坑,给雄安新区的水环境带来隐患,目前正采用多种方法对污水进行处理,改善水资源状况。
(1)在微生物作用的条件下,废水中的NH4+经过两步反应氧化成NO3-,两步反应的能量变化示意图如下:
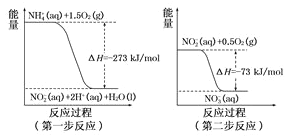
①第一步反应是______反应(选填“放热”或“吸热”),判新依据是_________。1mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式为_____________。
②一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该过程中CH3OH反应生成CO2,则参加反应的还原剂和氧化剂的物质的量之比为______.
(2)二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂,可以投入废水中清除污染物。
①二氧化氯可以将废水中的氰化物(CN-)氧化成两种无污染气体.写出离子方程式________。
②废水中的重金属离子的危害性很大,二氧化氯能够在弱酸性溶液中把二价锰离子氧化成不溶于水的二氧化锰(MnO2),写出反应的离子方程式_______________。
【答案】 放热 △H=-273kJ/mol(或反应物的总能量大于生成物的总能量) NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l) △H=-346kJ/mol 5:6 2ClO2+2CN-=2CO2+N2+2Cl- 2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl-
【解析】(1)①从图中得到第一步反应的反应物的能量高于生成物的能量,所以是放热反应。从左图得到NH4+(aq)+3/2O2(g)=2H+(aq)+NO2-(aq)+H2O(l) △H=-273kJ/mol;从右图得到NO2-(aq)+1/2O2(g) = NO3-(aq) △H=-73kJ/mol;两个方程式相加得到:NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l) △H=-346kJ/mol。
②明显得到氧化剂为HNO3,还原剂为CH3OH。CH3OH中的C为-2价(有机物中一般默认H为+1价,O为-2价),生成的CO2中C为+4价,所以一个CH3OH在反应中失去6个电子。HNO3中N为+5价,反应后生成的N2中N为0价,所以一个HNO3得到5个电子。为保证得失电子守恒,还原剂(CH3OH)和氧化剂(HNO3)的物质的量之比为5:6。
(2)①二氧化氯可以将废水中的氰化物(CN-)氧化成两种无污染气体,这两种无污染的气体只能是二氧化碳和氮气,二氧化氯本身被还原的产物应该是氯离子。CN-中C为+2价,N 为-3价,所以CN-要升高2+3=5价,ClO2降低5价,根据化合价升降相等和原子个数守恒配平,得到:2ClO2+2CN-=2CO2+N2+2Cl-。
②二氧化氯能够在弱酸性溶液中把二价锰离子氧化成不溶于水的二氧化锰(MnO2),本身被还原转化为氯离子,根据化合价升降相等和原子个数守恒配平,得到:2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl-。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大
B.对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小
C.活化分子间发生的碰撞为有效碰撞
D.使用催化剂,活化分子百分数增多,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为CO(g)+2H2(g) ![]() CH3OH(g) △H=-99kJ/mol。
CH3OH(g) △H=-99kJ/mol。
(1)关于该反应的下列说法,错误的是___________。
A.消耗CO和消耗CH3OH的速率相等时,说明该反应达到平衡状态
B.升高温度,正反应速率减小,逆反应速率增大
C.使用催化剂,可以提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(2)在某温度时,将1.0mol CO 与2.0 mol H2充入2 L的空钢瓶中,发生上述反应,在第5 min时达到化学平衡状态,此时甲醇的物质的量分数为10%。甲醇浓度的变化状况如图所示:

①从反应开始到5 min 时,生成甲醇的平均速率为________。
②5 min 时达到平衡,H2的平衡转化率α=_____%.化学平衡常数K= _______。
③1min 时的v正(CH3OH)______ 4min 时v逆(CH3OH ) (填“大于“小于“或“等于”)。
④若将钢瓶换成同容积的绝热钢瓶,重复上述实验,平衡时甲醇的物质的量分数_____0.1(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿( 主要成分MnO2)制高锰酸钾的流程如下(部分条件和产物省略):
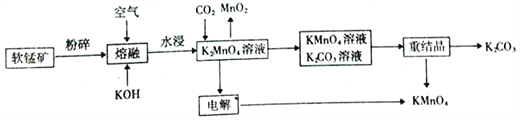
请回答下列问题:
(1)在“水浸”过程中,提高K2MnO4浸出率(浸出的K2MnO4质量与“熔块”质量之比)的措施有_______( 至少写出两点)。
(2)“熔融”过程中发生反应的化学方程式为___________。
(3)CO2 与K2MnO4反应的离子方程式为___________。
(4)“电解”过程中使用的是惰性电极,则:
①阳极反应的方程式为__________。
②阴极附近溶液的pH将__________。(填“增大”“减小” 或“ 不变”)。
(5)在上述过程中产生的Mn2+会对环境造成污染。工业上,通过调节pH使废水中的Mn2+形成Mn(OH)2 沉淀。当pH=10时,溶液中的c(Mn2+)=______(已知:Ksp[Mn(OH)2]=2.0×10-13。相关数据均在常温下测定)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
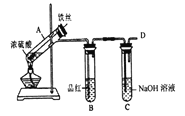
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com