
【题目】(1)将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。

则:①写出下列物质的化学式:
丙__________,B____________,C__________, D____________。
②写出甲跟乙反应的化学方程式:__________________________。
③单质丙与溶液乙反应生成气体B的离子方程式:___________________。
(2)如图是各物质的反应关系图:已知A和E都是黄色粉末,F有刺激性气味且有漂白性。请据此回答下列问题:

写出图中编号的化学方程式:
①_______________________;
②_______________________;
③______________________。
【答案】Cu NO CaCO3 Cu(NO3)2 C+4HNO3![]() CO2↑+4NO2↑+2H2O 3Cu+8H++2NO3-===2NO↑+3Cu2++4H2O 2Na2O2+2CO2===2Na2CO3+O2 Cu+2H2SO4(浓)
CO2↑+4NO2↑+2H2O 3Cu+8H++2NO3-===2NO↑+3Cu2++4H2O 2Na2O2+2CO2===2Na2CO3+O2 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 2SO2+O2
CuSO4+SO2↑+2H2O 2SO2+O2![]() 2SO3
2SO3
【解析】
(1)可从蓝色溶液(含Cu2+ )和白色沉淀(CaCO3 )逆推,单质丙为Cu,与之反应的溶液为HNO3 ;图中的气体中含CO2 ,因该气体是气体A通过水后产生的,故气体B只能是NO,气体A则应为CO2 和NO2 的混合物,进一步推出红热固体单质甲为碳,显黄色的溶液乙为浓硝酸;
(2)A和E都是黄色粉末,A与二氧化碳反应,则A为Na2O2,F有刺激性气味且有漂白性常被不法商人用来漂白腐竹,F为SO2;由元素守恒可知,E为S,再由转化关系图可知,B为Na2CO3,C为O2,G为SO3,H为H2SO4,然后结合元素化合物性质及化学用语来解答。
(1)单质丙和A与水反应后的溶液发生反应生成蓝色溶液,则该蓝色溶液中含有铜离子,气体A和水反应生成的溶液应该是酸,则丙是Cu,铜和稀硝酸在常温下反应,则A与水反应后的溶液中含有HNO3,气体B是NO,根据元素守恒知,A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,根据元素守恒及物质颜色知,甲是C,乙是浓硝酸,则A中含有CO2、NO2,
根据以上分析知,甲、乙、丙分别是:C、HNO3(浓)、Cu,A为CO2、NO2,B为NO,C为CaCO3,D为Cu(NO3)2,
故①丙为Cu,B为NO,C为CaCO3, D为Cu(NO3)2;
②甲跟乙反应的化学方程式为C+4HNO3![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
③单质丙与溶液乙反应生成气体B的离子方程式为3Cu+8H++2NO3-===2NO↑+3Cu2++4H2O;
(2)A和E都是黄色粉末,A与二氧化碳反应,则A为Na2O2,F有刺激性气味且有漂白性常被不法商人用来漂白腐竹,F为SO2;由元素守恒可知,E为S,再由转化关系图可知,B为Na2CO3,C为O2,G为SO3,H为H2SO4,
①反应①2Na2O2+2CO2═2Na2CO3+O2;
②反应②Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
③反应③2SO2+O2![]() 2SO3。
2SO3。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
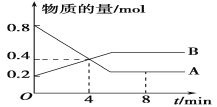
①该反应的化学方程式为____________________;
②反应开始至4 min时,B的平均反应速率为________ ,A的反应速率为_____ ,A的转化率为_____。
③4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
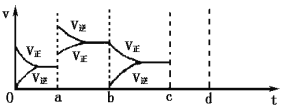
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g)![]() 2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A. 放电时,负极的电极反应为:H2-2e-=2H+
B. 充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O
C. 充电时,将电池的碳电极与外电源的正极相连
D. 放电时,OH-向镍电极作定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下所表示

下列说法错误的是( )
A. 该反应的化学方程式为2A![]() 4B+C B. 逆反应是放热反应
4B+C B. 逆反应是放热反应
C. 4min时A的转化率约为31% D. 4~6min时,反应处于动态平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I-![]() 2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是_____________________________;在不改变反应物用量的前提下,改进的方法是_____________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
(3)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。

①反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为_________________________。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001mol·L-1·s-1
B. 将容器体积变为20L,Z的平衡浓度变为原来的![]()
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为__________,基态铝原子核外电子云形状有_______(填形状名称)
(2)丙烯腈(CH2=CH-CN)分子中σ键和π键的个数比为_______,分子中碳原子轨道的杂化类型是________。
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式________、_______。
(4)钛存在两种同素异构体,α-Ti为六方最密堆积,β-Ti为体心立方堆积,鉴别两种钛晶体可以用_______法,由α-Ti转变为β-Ti晶体体积_________(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_________形象化描述。
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为_________,若阿伏加德罗常数为NA,晶胞的边长为apm,该晶体的密度为_________g·cm-3
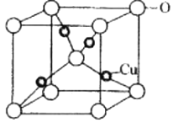
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com