
【题目】某化学学习小组用如下图所示装置制备、收集Cl2,并进行性质验证实验(夹持装置略去)。下列说法正确的是( )

A. 用![]() 和浓盐酸制备
和浓盐酸制备![]() 时,只选
时,只选![]()
B. ![]() 用于
用于![]() 收集时,a为进气口
收集时,a为进气口
C. ![]() 中加入NaBr溶液和
中加入NaBr溶液和![]() ,通入
,通入![]() 反应后振荡、静置,下层溶液呈橙红色
反应后振荡、静置,下层溶液呈橙红色
D. ![]() 中通入
中通入![]() 使品红溶液褪色后,取出溶液加热可恢复红色
使品红溶液褪色后,取出溶液加热可恢复红色
【答案】C
【解析】
A. KMnO4和浓盐酸制备Cl2为固液不加热型发生装置;
B. 氯气的密度比空气大;
C. 通入Cl2反应后生成易溶于CCl4的Br2;
D. 氯水具有漂白性,不可逆。
A. KMnO4和浓盐酸反应制备Cl2,①不可行,高锰酸钾可溶于水,氯气可以从长颈漏斗中逸出。选②可达到实验目的,故A项错误;
B. 排空气法收集氯气时,因氯气的密度比空气大,则应从b进气,故B项错误;
C. Cl2的氧化性比Br2大,通入NaBr溶液中,会发生氧化还原反应生成Br2,进而被CCl4萃取在下层溶液中,显橙红色,故C项正确;
D. Cl2能使品红溶液褪色,主要是发生了氧化还原反应,不可逆,因此取出溶液加热不能恢复红色,故D项错误;
答案选C。


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为_________________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在____________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:_________。
③NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2-的水解常数K=2×10-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为__________。
II.T ℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn(NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:

(3)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下浓度均为1×10﹣3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④硫酸铵、⑤氨水、⑥氢氧化钠溶液,回答下列问题:
(1)氨水的电离方程式为_______,硫酸铵在水溶液中水解的离子方程式为___________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③________⑥(填“>”、“=”或“<”),溶液中的离子浓度由大到小的顺序为____________________________。
(3)在某温度下(Kw=1×10﹣12),将100 mL的①与100 mL的⑥溶液混合后(假设混合后溶液的体积为混合前两溶液的体积之和),溶液的pH=_________。
(4)若将等体积的②、③溶液加热至相同温度后,溶液的pH ②_______③(填“>” 、“=”或“<”)。
(5)室温时,若用①滴定⑤,适宜的指示剂为_____,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从铜电解工艺的阳极泥中提取Se和Te的流程如下:
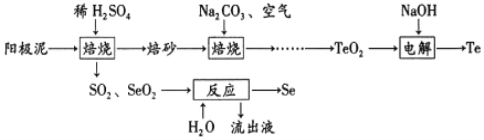
下列叙述错误的是( )
A. 合理处理阳极泥有利于保护环境和资源再利用
B. 流出液是H2SO4溶液
C. 电解过程中阴极上析出单质Te
D. “焙砂”与碳酸钠充分混合后,可在瓷坩锅中焙烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为_______molL﹣1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl﹣的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”,填C表示“无影响”)。
I.用量筒量取浓盐酸时俯视观察凹液面________;
II.转移浓溶液时操作不慎,有一滴液体溅出容量瓶________;
III.定容摇匀后,发现液面低于刻度线________;
IV.定容时,俯视读数,所得溶液的浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是

A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减小
B. HA的电离常数KHA=10-7x/(100-x)(x为滴定分数)
C. 当滴定分数为100时,溶液中水的电离程度最大
D. 滴定分数大于100时,溶液中离子浓度关系是c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员将Cu与Cu2O的混合物ag,用足量的稀H2SO4充分反应后,剩余固体质量为bg。
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)混合物中n(Cu2O)=________mol(用含a、b的最简式表示)
(2)若将ag混合物在空气中加热生成CuO,则m(CuO)=_______g(用含a、b的最简式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com