
【题目】
(1)氧化银是黑色固体,其含银量相当高,从废氧化银中冶炼银,可采用的方法是__________,反应方程式是__________________。
(2)检验X-的性质时,常生成AgX沉淀,如果将AgX(AgCl、AgBr、AgI)等丢弃,则十分可惜。试设计实验方案,从AgX中回收白银。
__________________________。
(3)常有不法职业人员从实验室中带出AgNO3,到银匠店铺灼烧制取白银。发生反应的方程式为____________________;同时看到有红棕色气体生成,该气体对人体十分有害,其主要成分是_______(写化学式)。
【答案】 热分解法 2Ag2O![]() 4Ag+O2↑ 过滤,从废液中回收AgX;将AgX置于坩埚中加热(在通风橱中进行),冷却,可得白银 2AgNO3
4Ag+O2↑ 过滤,从废液中回收AgX;将AgX置于坩埚中加热(在通风橱中进行),冷却,可得白银 2AgNO3![]() 2Ag+2NO2↑+O2↑ NO2
2Ag+2NO2↑+O2↑ NO2
【解析】试题分析:(1)氧化银易分解生成单质银,可用热分解法冶炼银;(2)AgX不稳定,见光或热分解可生成单质银;(3)AgNO3不稳定,见光或加热可分解生成银,同时生成二氧化氮气体。
解析:(1)氧化银易分解生成单质银,可用热分解法冶炼银,方程式为2Ag2O![]() 4Ag+O2↑
4Ag+O2↑
(2)AgX不稳定,见光或热分解可生成单质银,从AgX中回收白银,可过滤浊液,从废液中回收AgX,将AgX置于坩埚中加热(在通风橱中进行),冷却,可得白银;
(3)AgNO3不稳定,见光或加热可分解生成银,同时生成二氧化氮气体,反应的方程式为2AgNO3![]() 2Ag+2NO2↑+O2↑ ;红棕色气体是NO2。
2Ag+2NO2↑+O2↑ ;红棕色气体是NO2。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图装置中,U形管B中所装固体为________,C中球形干燥管的作用是_______________________。
(2)关闭K1打开K2,再打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_______________________________________。
(3)由于上述装置还存在____________缺陷,导致测定结果偏高。
【方案2】按以下步骤测定样品中AlN的纯度:
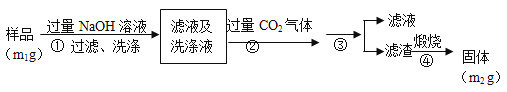
(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作中用到的主要玻璃仪器是_________。AlN的纯度是__________(用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天工业材料——钛合金的重要原料。实验室以TiO2和CCl4为原料制取液态TiCl4的装置如图所示(部分夹持装置省略)。

已知:有关物质的性质如下表:

请回答下列问题:
(1)仪器A的名称是_____________,仪器A中盛装的试剂是_____________。
(2)CCl4的电子式为________________。
(3)装置C处硬质玻管中反应的化学方程式为_________________。
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为_______________。
(5)仪器N中收集到的物质主要有_____(写化学式),从产物中分离出TiCl4的实验方法是________________。
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,该感应中氧化剂与还原剂的物质的量之比为_______。请设计实验方案验证产物气体中有CO:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是( )
X | Y | Z | |
A | NaHCO3溶液 | Na2CO3 | BaCl2溶液 |
B | FeCl3溶液 | CuCl2 | Fe |
C | Fe2O3 | Al2O3 | NaOH溶液 |
D | Na2SO4溶液 | Na2CO3 | 盐酸 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、T、Y、Z为1﹣36号元素,且原子序数依次增大,四种元素的性质或结构信息如表。请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质结构信息 | 人体内含量最多的元素,且其单质是最常见的助燃剂。 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼。 | 第3周期元素的简单离子中半径最小。 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子。 |
(1)写出元素T的离子结构示意图______________;写出元素X的气态氢化物的电子式__________;写出Z元素原子的外围电子排布式__________;元素Y的原子核外共有_______种形状不同的电子云。
(2)Y元素原子的第一电离能______镁(填“>”“<”“=”),从结构上分析,其理由是:__________________。
(3)元素T与氟元素相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是_______(填序号字母)。
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaClO+CO2+H2O=NaHCO3+HClO 之所以能发生解释正解的是( )
A.该反应不能发生,不符合复分解反应发生条件,无沉淀或气体或水,应该左右倒过来写
B.该反应是复分解反应,能发生的原因可能是碳酸酸性比HClO强,符合强酸制弱酸原理
C.该反应不是复分解反应是氧化还原反应,自然不能套用复分解反应条件或规律
D.该反应可能是NaHCO3难溶于水,正好符合复分解反应发生条件之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J是一种燃料油添加剂,其合成路线如下:
已知:2CH3COOH ![]()
![]() + H2O
+ H2O

请回答下列问题:
(l)反应类型:a _______________、b _______________、p ______________
(2)A分子中有3种化学环境不同的氢原子,A的结构简式是___________________;
(3)F的结构简式是___________________,H的结构简式是___________________;
(4)① F转化为G的化学方程式是________________________________________;
② E+K→J的化学方程式是__________________________________________;
(5)下列说法中不正确的是 ____________。
① CH2=CH—CH3和CH2=CH—CH=CH2互为同系物
② G转化为H可以用酸性高锰酸钾溶液作为氧化剂
③ H转化为K属于消去反应
(6)与D具有相同官能团的D的同分异构体还有 _____________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com