
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图装置中,U形管B中所装固体为________,C中球形干燥管的作用是_______________________。
(2)关闭K1打开K2,再打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_______________________________________。
(3)由于上述装置还存在____________缺陷,导致测定结果偏高。
【方案2】按以下步骤测定样品中AlN的纯度:
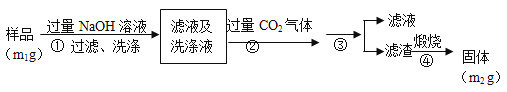
(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作中用到的主要玻璃仪器是_________。AlN的纯度是__________(用m1、m2表示)。
【答案】⑴ 碱石灰(或其他合理答案) 防止倒吸
⑵ 把装置中残留的氨气全部赶入C装置
⑶未排除C装置出口处空气中水蒸气的干扰
⑷ CO2 +AlO2-+2H2O =HCO3-+Al(OH)3↓
⑸漏斗、烧杯、玻璃棒 ![]()
【解析】【方案1】(1)上图装置中,U形管B中所装固体为碱石灰,是用来干燥氨气的;氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用;
(2)通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
【方案2】(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(5)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量,Al2O3物质的量=![]() =
=![]() mol,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)=
mol,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)=![]() mol×2=
mol×2=![]() mol,A1N的纯度=
mol,A1N的纯度=![]() ×100%=
×100%=![]() 。
。


科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:

已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
(3)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。

(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.液态氯化氢、固体氯化钠均不导电,所以氯化氢、氯化钠均是非电解质
B.铜丝能导电,所以铜丝是电解质
C.NH3、SO2的水溶液均能导电,所以NH3、SO2均是电解质
D.蔗糖、酒精在水溶液和熔化状态下均不导电,所以它们是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此氯化铬最可能是 ( )
A. [Cr(H2O)6]Cl3B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2OD. [Cr(H2O)3Cl3]·3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 常温常压下,7.8g苯中含有单键的数目为0.9NA
B. 标准状况下,14g氮气含有的核外电子数为5NA
C. 标准状况下,2.24LH2与02的混合物中含有的分子数为0.1NA
D. 常温下,lL0.1mol·L-1的NH4N03溶液中氧原子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)氧化银是黑色固体,其含银量相当高,从废氧化银中冶炼银,可采用的方法是__________,反应方程式是__________________。
(2)检验X-的性质时,常生成AgX沉淀,如果将AgX(AgCl、AgBr、AgI)等丢弃,则十分可惜。试设计实验方案,从AgX中回收白银。
__________________________。
(3)常有不法职业人员从实验室中带出AgNO3,到银匠店铺灼烧制取白银。发生反应的方程式为____________________;同时看到有红棕色气体生成,该气体对人体十分有害,其主要成分是_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2的混合气体共3 g,与足量的过氧化钠置于密闭容器中,通入足量氧气用电火花点燃,则固体的质量增加了
A. 3 g B. 3.2 g
C. 4.4 g D. 5.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_________,由此可知草酸晶体分解的产物中有_______。装置B的主要作用是________。

(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A、B、______。装置H反应管中盛有的物质是_______。
②能证明草酸晶体分解产物中有CO的现象是_______。
(3)设计实验证明:
①草酸的酸性比碳酸的强______。
②草酸为二元酸______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com