
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3+��SO2 �� ijС����ͼ��ʾװ�ý���ʵ�飨�г�������A�еļ���װ�����ԣ��������Ѿ�������ϣ�ʵ�������ͼ�� 
���ɼ�K1��K4 �� ͨ��һ��ʱ��N2 �� �ٽ�T�͵��ܲ���B�У�����ͨ��N2 �� Ȼ��ر�K1��K3��K4 ��
����a���μ�һ������Ũ���ᣬ��A���ȣ�
��B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2 ��
��������b��ʹԼ2mL����Һ����D�Թ��У��������е������ӣ�
�������ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3 ��
���������Թ�D���ظ����̢�������B��Һ�е����ӣ�
��1�����̢��Ŀ���� ��
��2�����н������ҺΪ �� ������
��3��A�з�����Ӧ�Ļ�ѧ����ʽ ��
��4�����²��������Һ��Ƶ����ӷ�Ӧ�� �� ����д�Լ���ѧʽ������������������� ��
��5����˵��������Fe3+��SO2�����ӷ���ʽ�� ��
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������Cl2��Fe3+��SO2��������ס����ҡ�����������
���̢�B��Һ�к��е����� | ���̢�B��Һ�к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
���𰸡�
��1���ų�װ���е�����
��2������������Һ������Cl2��SO2,��ֹ��Ⱦ����
��3��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��4��2Fe2+Cl2�T2Fe3++2Cl���� KSCN����Һ���
��5��2Fe3++SO2+2H2O=2Fe2++SO42��+4H+
��6���ұ�
���������⣺��1��װ���д������������ʵ��������Ӱ�죬�����ž�װ���еĿ�����
���Դ��ǣ��ų�װ���е���������2��Cl2��SO2�ж���Ⱦ������Ӧ��β��������װ���е�����Ҫ����ǿ����Һ����Cl2��SO2����ֹ��Ⱦ������
���Դ��ǣ�����������Һ������Cl2��SO2����ֹ��Ⱦ��������3��A�з�����ӦΪ�Ʊ���������Ӧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����4����B����Һ���ʱ�����������������������������ӣ����ӷ���ʽΪ��2Fe2+Cl2�T2Fe3++2Cl������KSCN��Һ�������������ӣ���������Һ��죻
MnCl2+Cl2��+2H2O����4����B����Һ���ʱ�����������������������������ӣ����ӷ���ʽΪ��2Fe2+Cl2�T2Fe3++2Cl������KSCN��Һ�������������ӣ���������Һ��죻
���Դ��ǣ�2Fe2+Cl2�T2Fe3++2Cl����KSCN����Һ��죻��5������������ԭ��Ӧ����������������ǿ�ڻ�ԭ���������ԣ�����˵��������Fe3+��SO2�����ӷ���ʽ���������������������������ɶ�������������������ӷ���ʽΪ��2Fe3++SO2+2H2O=2Fe2++SO42��+4H+�����Դ��ǣ�2Fe3++SO2+2H2O=2Fe2++SO42��+4H+����6������������������ԭ��Ӧ����������������ǿ���������Ҳǿ�ڻ�ԭ���������ԣ�
�ף�B�����д����ܽ����������SO2���ʴ���
�ң�B�д���Fe3+��Fe2+��˵��Cl2������ǿ��Fe3+����û��Cl2ʣ�࣬�ʺ���SO42����˵��Fe3+������ǿ��SO2������ȷ��
����B�д���Fe3+��˵��Cl2������ǿ��Fe3+����������Fe2+��ֻ����Fe3+��SO2��ԭ������ȷ��
��ѡ���ұ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��Һ��K2C2O4��Һ��Ϸ�Ӧ������֮һ��ij��ֻ��һ�������ӵ���ɫ����ˮ���ͨ������ʵ��ȷ���þ������ɣ�
����a����ȡ0.6720g��Ʒ��������ƿ����������2molL��1ϡ���ᣬ��ʹ��Ʒ�ܽ⣮�ټ���30mLˮ���ȣ���0.2000molL��1 KMnO4��Һ�ζ����յ㣬����8.00mLKMnO4��Һ��
����b�����Ž���Һ��ּ��ȣ�ʹ���Ϻ�ɫ��ʧ����Һ���ճ�����ɫ����ȴ����pH�����������KI���壬��Һ��Ϊ��ɫ��������ɫ����CuI����0.2500molL��1 Na2S2O3����Һ�ζ����յ㣬����8.00mLNa2S2O3��Һ��
��֪�漰�IJ��ַ�Ӧ�����ӷ���ʽΪ��
����a��2MnO4��+5C2O42��+16H+=2Mn2++8H2O+10CO2��
����b��2Cu2++4I��=2CuI��+I2 I2+2S2O32��=2I��+S4O62��
��1����֪������CuI��Ksp=1.27��10��12 �� ��ʹ��Һ��c��Cu+����1.0��10��6molL��1 �� Ӧ������Һ��c��I������molL��1 ��
��2��MnO4�������������£������ֽܷ�ΪO2 �� ͬʱ����Mn2+ ��
д���÷�Ӧ�����ӷ���ʽΪ ��
���˼��Ȳ�������ⶨ��Cu2+�ĺ����������ƫ�ߡ�����ƫ�͡����䡱����
��3������b�õ�����Һ��ָʾ������ζ��յ�۲쵽������Ϊ ��
��4��ͨ������ȷ����Ʒ�������ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����λͬѧ�ֱ�������������ʵ�飮
ʵ��һ�����ᾧ�壨H2C2O4����Ũ�����ϻ�������ʱ���ɷ������·�Ӧ��H2C2O4=CO2��+CO��+H2O����ͬѧ�������ͼ1ʵ��װ�ã�������ȡ���﴿����CO���壬�������ɵ�CO���廹ԭFexOy �� ��ȡ���ۣ�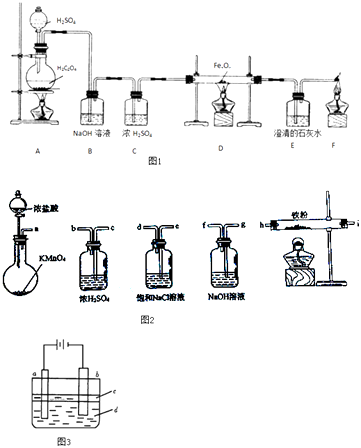
��1��װ��B�������� �� װ��E�е������� �� װ��F�������� ��
��2����FexOyΪ0.4g�����ɵ��������������ʯ��ˮ��Ӧ����0.75g��ɫ��������FexOy�Ļ�ѧʽΪ ��
ʵ�������ͬѧ����ͼ2��ʾ������ʵ�����Ʊ�������ˮFeCl3 �� ������������˳����������˳����� ��
ʵ��������ͬѧ����ͼ3ʵ��װ�ÿ��Ƶô�����Fe��OH��2�������������Ϸֱ�Ϊʯī������
��a�缫����Ϊ �� ��缫��ӦʽΪ ��
��Һ��cΪ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����������ͬ�������ڵ�����Ԫ�أ�̼�����������仯��������������ͿƼ��ȷ�������Ҫ��Ӧ�ã���ش��������⣺
��1��̼���������ĵ�һ�������ɴ�С˳��Ϊ
��2��H2O������ԭ���ӻ�����ռ乹��Ϊ �� ��̬H2O�ľ�������Ϊ ��
��3���Ƚϼ��ǵĴ�С��H2OCH4���������������=������ԭ��Ϊ
��4��Ԫ��M��������NH4+����������������������ͬ����M��ԭ�ӽṹʾ��ͼΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ��Һ�к���Fe��NO3��3��Cu��NO3��2��HNO3 �� �������������ۣ���Һ��Fe2+��Ũ����������۵����ʵ���֮��Ĺ�ϵ��ͼ��ʾ������Һ��Fe��NO3��3��Cu�� NO3��2��HN03���ʵ���Ũ��֮��Ϊ�������� 
A.1��1��1
B.1��3��1
C.2��1��4
D.1��1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һδ��ɵ����ӷ���ʽ���� ��+XO3��+6H+�T3X2+3H2O���ݴ��ж�����˵����ȷ���ǣ� ��
A.Xԭ���������5������
B.����1mol X2����ʱ������2mol����ת��
C.��������ͻ�ԭ��������ʵ���֮��Ϊ5��1
D.���� �������������XO3�����κλ����¶����ܹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1��ij�����з�����һ����ѧ��Ӧ����Ӧ�����д���H2O��ClO����CN����HCO3����N2��Cl���������ӣ��ڷ�Ӧ�����в��ClO����N2�����ʵ�����ʱ��仯��������ͼ��ʾ�� 
�÷�Ӧ�����ӷ���ʽ�� ��
��2�������������Ǵ�����Ⱦ����Ҫ�����أ���NOxת��Ϊ�������ǵ�ǰ�о�����Ҫ���⣮
����ʽ��X����Ϊ����Ⱦ�����ʣ�ϵ��n����Ϊ0��
NO2+G ![]() N2+H2O+nX��δ��ƽ�ķ�Ӧʽ����
N2+H2O+nX��δ��ƽ�ķ�Ӧʽ����
���л������У�����������Ӧʽ�е�G������д��ĸ����
a��NH3 b��CO2 c��SO2 d��CH3CH2OH
����GΪ��Ȼ������Ҫ�ɷ֣���XΪ �� n= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��ͨ���������ϣ��������ͼ��ʾ�ķ����Ժ����ϴ���Ϊԭ�����Ʊ�NiSO47H2O����֪ij�������ĺ����ϴ�����Ҫ����Ni��������Al��31%����Fe��1.3%���ĵ��ʼ�����������������ʣ�3.3%���� 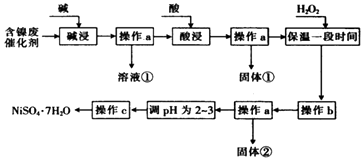
����������������������ʽ����ʱ��pH�����
������ | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Al��OH��3 | 3.8 | 5.2 |
Fe��OH��3 | 2.7 | 3.2 |
Fe��OH��2 | 7.6 | 9.7 |
Ai��OH��2 | 7.1 | 9.2 |
��1��������������з�����Ӧ�����ӷ���ʽ��
��2���������ʱ��������������ѧʽ����
��3������H2O2ʱ������Ӧ�����ӷ���ʽΪ
��4������bΪ������Һ��pH������ΪpH�ĵ��ط�Χ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ���ܳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��3Zn+2K2FeO4+8H��1O ![]() 3Zn��OH��2+2Fe��OH��3+4KOH��������������ȷ���ǣ� ��
3Zn��OH��2+2Fe��OH��3+4KOH��������������ȷ���ǣ� ��
A.�ŵ�ʱÿת��3mol���ӣ�������1mol K2FeO4������
B.���ʱ������ӦΪ��Fe��OH��3��3e��+5 OH���TFeO ![]() +4H2O
+4H2O
C.�ŵ�ʱ����������Һ�ļ�����ǿ
D.�ŵ�ʱ������ӦΪ��Zn��2e��+2OH���TZn��OH��2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com