

分析 (1)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(2)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
(3)原电池中电子从负极经外电路流向正极,负极反应氧化反应,结合电解质书写电极反应式;据c为负极,d为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;根据电子得失守恒以及精铜中铜离子得到电子来计算.
解答 解:(1)由热化学方程式①2CO(g)+O2(s)=2CO2(g)△H1=-566.0kJ•mol-1
②S(s)+O2(g)=SO2 (g)△H2=-296.0kJ•mol-1
根据盖斯定律,①-②得到2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270 kJ•mol-1;
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270 kJ•mol-1;
(2)设CO转化的浓度为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
K=9.0=$\frac{{x}^{2}}{(0.30-x)^{2}}$,x=0.225,
所以CO的转化率α(CO)=$\frac{0.225mol/L}{0.30mol/L}$×100%=75%,
氢气反应速率v(H2)=$\frac{0.225mol/L}{5min}$=0.045mol•L-1•min-1,
故答案为:75%;0.045;
(3)甲醇具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
因c为负极,d为正极,粗铜精炼时,粗铜作阳极,与电源的正极d相连,
精铜电极电极反应式:Cu2++2e-=Cu,Cu2+的物质的量为=$\frac{64g}{64g/mol}$=1mol,由电子得失守恒可知电子转移2mol,原电池中正极电极反应为4OH--4e-=2H2O+O2↑,则生成氧气物质的量为0.5mol,标况下的体积=0.5mol×22.4L/mol=11.2L;
故答案为:负极;CH3OH-6e-+H2O=CO2+6H+;d;11.2.
点评 本题考查了化学平衡常数的求算、电解质原理、原电池原理、氧化还原反应,综合性强,难度中等.


科目:高中化学 来源: 题型:解答题
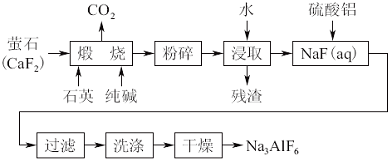
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.0 g熔融的NaHSO4中含有离子总数为0.2NA | |
| B. | 电解精炼Cu时,导线中通过2NAe-时,阳极质量减少64 g | |
| C. | 标准状况下,11.2 LCHCl3中含有的共用电子对数目为2NA | |
| D. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
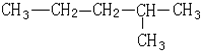
| A. | 该有机物属于烷烃 | |
| B. | 该烃与2,3-二甲基丁烷互为同系物 | |
| C. | 该烃的一氯取代产物共有5种 | |
| D. | 该有机物可由两种单炔烃分别与氢气加成得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的球棍模型为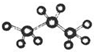 | B. | 丙烯的结构简式为CH3CHCH2 | ||
| C. | 符合通式CnH2n+2的一定是烷烃 | D. | O2、O3属于同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com