
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
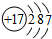
分析 由元素在周期表的位置可知,①为N,②为F,③为Mg,④为Al,⑤为Si,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)S位于第三周期第VIA族,Cl的原子结构中有3个电子层,最外层电子数为7;
(2)周期表中F的非金属性最强;
(3)③和②的离子具有相同电子层结构,原子序数大的离子半径小;
(4)非金属性越强,最高价氧化物的水化物的酸性越强;
(5)氧化铝具有两性,与KOH反应生成偏铝酸钾和水.
解答 解:由元素在周期表的位置可知,①为N,②为F,③为Mg,④为Al,⑤为Si,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)S位于第三周期第VIA族,Cl的原子结构中有3个电子层,最外层电子数为7,原子结构示意图为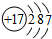 ,
,
故答案为:第三周期第VIA族;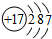 ;
;
(2)周期表中F的非金属性最强,故答案为:F;
(3)③和②的离子具有相同电子层结构,原子序数大的离子半径小,离子半径为F->Mg2+,故答案为:F->Mg2+;
(4)非金属性越强,最高价氧化物的水化物的酸性越强,酸性为HClO4>H2SO4,故答案为:HClO4>H2SO4;
(5)氧化铝具有两性,与KOH反应生成偏铝酸钾和水,离子反应为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质及元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强 | |
| B. | 以极性键结合的分子,不一定是极性分子 | |
| C. | 判断A2B或AB2型分子为极性分子必须知道该分子的空间构型 | |
| D. | 非极性分子中,各原子间都应以非极性键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体甲一定是Na2CO3 | |
| B. | 固体甲一定是NaHCO3 | |
| C. | 当吸收0.15molCO2时,所得固体甲中Na2CO3和NaHCO3物质的量相等 | |
| D. | 在固体甲中加入足量稀盐酸,充分反应后蒸干所得溶液,得到11.7gNaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素是典型的非金属元素,不能与其他非金属元素化合 | |
| B. | 卤素单质越活泼,其溶沸点就越低 | |
| C. | 卤素各单质都能和水剧烈反应 | |
| D. | 卤素气态氢化物的稳定性越强,还原性也越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| B. | 放电过程中,b电极附近溶液的pH减小 | |
| C. | 电池工作时,Na+从b极区移向a极区 | |
| D. | 若用该电池电解饱和食盐水,转移2 mole-时,阴极析出46gNa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 | |
| C. | 制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用氢氧化钠溶液收集产物 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.| ② | |||
| ⑦ | ⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com