
【题目】请回答下列问题:
(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为:____________;与M同一周期的主族元素中原子半径最小的是(填元素符号)________。
(2)含有元素M的化合物Q是淡黄色固体,写出Q的电子式:______________。
(3)氧化铝溶液与过量氨水反应的离子方程式为____________________________________________;
生成物NH4Cl中存在的化学键类型为_____________________________。
(4)元素X、Y在周期表中位于同一主族,化合物Cu2X和Cu2Y可发生如下转化(其中D是纤维素水解的最终产物):
Cu2X![]() 澄清溶液
澄清溶液![]() 悬浊液
悬浊液![]() Cu2Y(砖红色沉淀)
Cu2Y(砖红色沉淀)
①D的分子式是_____________。
②Cu2Y与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:_______________________。
③硒(Se)是人体必需的微量元素,与元素Y同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为_________,其最高价氧化物对应的水化物化学式为_____________________。
该族25周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+99.7 kJ mol-1 b.+29.7 J mol-1 c.-20.6 J mol-1 d.-241.8 J mol-1
表示生成1 mol硒化氢反应热的是___________(填字母代号)。
【答案】  Cl
Cl 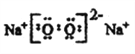 3NH3·H2O + Al3+=Al(OH)3↓+3NH4+ 离子键 共价键 C6H12O6 Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O 34 H2SeO4 b
3NH3·H2O + Al3+=Al(OH)3↓+3NH4+ 离子键 共价键 C6H12O6 Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O 34 H2SeO4 b
【解析】(1)NH4+所含电子数和质子数分别为10和11,说明元素M是钠离子,其原子结构示意图为: ;同周期主族元素从左到右原子半径依次减小,故与M同一周期的主族元素中原子半径最小的是Cl;(2)钠的化合物为淡黄色固体的是过氧化钠,其电子式为:
;同周期主族元素从左到右原子半径依次减小,故与M同一周期的主族元素中原子半径最小的是Cl;(2)钠的化合物为淡黄色固体的是过氧化钠,其电子式为: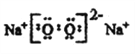 ;(3)氢氧化铝不溶于氨水,故氧化铝溶液与过量氨水反应的离子方程式为:3NH3·H2O + Al3+=Al(OH)3↓+3NH4+;NH4Cl中铵根离子和氯离子形成离子键,铵根离子中的氮原子和氢原子形成共价键;(4)①D是纤维素水解的最终产物,则D是葡萄糖,分子式为:C6H12O6;砖红色沉淀Cu2Y是氧化亚铜,悬浊液是新制氢氧化铜悬浊液,则澄清溶液是硝酸铜溶液,与过量浓硝酸反应的Cu2X是Cu2S;②Cu2O与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;③硒(Se)是人体必需的微量元素,与元素O同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为8+18+18=34,其最高价氧化物对应的水化物化学式为H2SeO4;同主族元素从上而下非金属性逐渐减弱,形成氢化物的稳定性逐渐减弱,则形成过程热效应增大(放热到吸热),Se是第四周期元素,则热效应应排第三,答案选b。
;(3)氢氧化铝不溶于氨水,故氧化铝溶液与过量氨水反应的离子方程式为:3NH3·H2O + Al3+=Al(OH)3↓+3NH4+;NH4Cl中铵根离子和氯离子形成离子键,铵根离子中的氮原子和氢原子形成共价键;(4)①D是纤维素水解的最终产物,则D是葡萄糖,分子式为:C6H12O6;砖红色沉淀Cu2Y是氧化亚铜,悬浊液是新制氢氧化铜悬浊液,则澄清溶液是硝酸铜溶液,与过量浓硝酸反应的Cu2X是Cu2S;②Cu2O与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;③硒(Se)是人体必需的微量元素,与元素O同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为8+18+18=34,其最高价氧化物对应的水化物化学式为H2SeO4;同主族元素从上而下非金属性逐渐减弱,形成氢化物的稳定性逐渐减弱,则形成过程热效应增大(放热到吸热),Se是第四周期元素,则热效应应排第三,答案选b。
。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。完成下列填空:
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
下列关于反应①的说法中正确的是______________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,反应转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应。
已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被2 mol KMnO4氧化的H2O2是____________mol。
(3)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色退去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
①写出一个包含上述七种物质的氧化还原反应方程式(需配平)________________。
②高锰酸钾溶液与硫化亚铁固体有如下反应:
10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬钙G是评价较好的解热、镇痛、消炎药,下面是它的一种合成路线(具体反应条件和部分试剂略)

已知①氯化亚砜(SOCl2)可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
② (X表示卤素原子)
(X表示卤素原子)
③R-X+NaCN![]() RCN+NaX
RCN+NaX
回答下列问题:
(1)写出D的结构简式:_______________。
(2)B→C的反应类型是___________;F中所含的官能团名称是_________。
(3)写出F和C在浓硫酸条件下反应的化学方程式_______________。
(4)A的同分异构体中符合以下条件的有______种(不考虑立体异构)
①属于苯的二取代物;②与FeCl3溶液发生显色反应。
其中核磁共振氢谱图中共有4个吸收峰的分子的结构简式为____________。
(5)结合上述推断及所学知识,参照上述合成路线任选无机试剂设计合理的方案,以苯甲醇(![]() )为原料合成苯乙酸苯甲酯(
)为原料合成苯乙酸苯甲酯(![]() )写出合成路线__________,并注明反应条件。
)写出合成路线__________,并注明反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
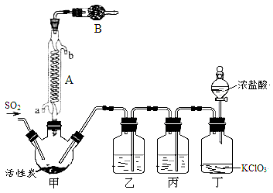
(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用,下列叙述正确的是
A. 白酒中混有少量的塑化剂,少量饮用对人体无害,可以通过过滤的方法除去
B. 将猕猴桃和苹果放在一起,猕猴桃更容易成熟。是因为苹果释放的乙烯具有催熟作用
C. 氨气可以做制冷剂,是因为氨气有一定的还原性
D. 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子,才能被人体吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑦种元素,根据题意回答以下问题:

(1)在③~⑦五种元素中,原子半径最大的是____________(填元素符号);
(2)②的原子结构示意图为__________;
(3)①~⑦对应元素中最高价氧化物对应的水化物酸性最强的是________(填化学式,下同),呈两性的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是广泛存在于植物中的一类芳香化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2,该芳香内酯A经下列步骤转变为水杨酸和和化合物E。

已知:
请回答下列问题:
(1)A中官能团的名称为_____________;化合物C的结构简式为______________。
(2)B生成C的反应类型为__________________,化合物E的化学名称是_________。
(3)写出A→B的化学方程式__________________________________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的二元取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有________种;写出其中核磁共振氢谱有5种峰,且其信号强度之比为1 :1 :2 :2 :2的任一种同分异构体的结构简式___________。
 合成
合成
(其他无机原料自选,用反应流程图表示,并注明反应条件)。_________
示例:原料![]() ……产物
……产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质制备与工业生产相符的是( )
A. 浓盐酸![]() Cl2
Cl2![]() 漂白粉
漂白粉
B. MgCl2溶液![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
C. FeS2![]() SO2
SO2![]() H2SO4
H2SO4
D. 饱和NaCl溶液![]() NaHCO3悬浊液
NaHCO3悬浊液![]() Na2CO3
Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com