
【题目】高锰酸钾是一种典型的强氧化剂。完成下列填空:
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
下列关于反应①的说法中正确的是______________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,反应转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应。
已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被2 mol KMnO4氧化的H2O2是____________mol。
(3)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色退去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
①写出一个包含上述七种物质的氧化还原反应方程式(需配平)________________。
②高锰酸钾溶液与硫化亚铁固体有如下反应:
10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________。
【答案】 a b c 5 2KMnO4+10KCl+8H2SO4===6K2SO4+2MnSO4+5Cl2↑+8H2O 0.1NA(或6.02×1022)
【解析】(1)a.反应中铜元素化合价从+1价升高到+2价,硫元素化合价从-2价升高到+4价,化合价升高的元素被氧化,所以被氧化的元素有S、Cu,a正确;b.锰元素化合价降低,从+7价降低为+2价,Cu2S元素化合价都升高做还原剂,1molMnO4-得到5mol电子,反应中铜元素化合价从+1价升高到+2价,硫元素化合价从-2价升高到+4价,1molCu2S失去8mol电子,则氧化剂与还原剂的物质的量之比为8:5,b正确;c.生成2.24LL(标况下)SO2时,物质的量为0.1mol;反应的Cu2S物质的量为0.1mol,反应中转移电子的物质的量是:
Cu+~Cu2+~e-; S2-~SO2~6e-;
1 1 1 6
0.2mol 0.2mol 0.1mol 0.6mol
所以电子转移共0.8mol,c正确;
d.氧化还原反应中还原剂的还原性大于还原产物的还原性,则还原性的强弱关系是:Mn2+<Cu2S,d错误。答案选abc;
(2)Mn从+7价降低到+2价得到5个电子,2 mol KMnO4得到10mol电子,由H2O2-2e→2H++O2↑和电子得失守恒可知,被氧化的 H2O2的物质的量是10mol÷2=5mol;
(3)①高锰酸钾具有强氧化性,因此高锰酸钾是氧化剂,氯化氢是还原剂,氯气是氧化产物,反应的方程式为2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O;②反应中固体质量变化为:FeS→S,固体质量变化为铁元素的变化;反应前后固体的质量减少了2.8g,
参加反应的亚铁离子的物质的量为: ![]() =0.05mol,即被氧化的FeS的物质的量为0.05mol,被高锰酸根离子氧化的硫元素元素的物质的量为0.05mol,转移的电子的物质的量为:0.05mol×2=0.1mol,电子数目为:0.1NA。
=0.05mol,即被氧化的FeS的物质的量为0.05mol,被高锰酸根离子氧化的硫元素元素的物质的量为0.05mol,转移的电子的物质的量为:0.05mol×2=0.1mol,电子数目为:0.1NA。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 中性溶液中:K+、Fe3+、SO42—、Cl—
B. 水电离的c(H+)=1×10—13mol/L的溶液中:K+、Na+、[Al(OH)4]—、CO32—
C. 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3—、SO42—
D.  = 1×10—13mol/L的溶液中:K+、Cu2+、Cl—、NO3—
= 1×10—13mol/L的溶液中:K+、Cu2+、Cl—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4; C4H10→CH4+C3H6;某化学兴趣小组的同学为探究丁烷裂解气中CH4和C2H6的比例关系,设计如图所示实验:
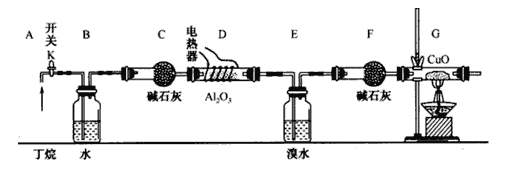
注:CuO能将烃氧化成CO2和H2O;A12O3是丁烷裂解的催化剂,G后面装置已省略。如图连接好装置后(部分夹持装置已略去),需进行的实验操作有:
①给D、G装置加热:②检査整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是____________。
(2)简要说明检验空气排尽的方法:_______________________________________________。
(3)B装置所起的作用是__________________________________________。
(4)假设丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了 1.82g, G装置中固体质量减少了 4.l6g,则丁烷的裂解产物中n(CH4)∶n(C2H6)=_____________。
(5)若对E装置中的混合物再按以下流程实验:

①分离操作I、Ⅱ的名称是I_____________、 II_______________;
②Na2SO3溶液的作用是(用离子方程式表示)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的HX,HY溶液,pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )

A. 当V(NaOH)=0 mL时,c(X-)>c(Y-)
B. a点时:c(Y-)+c(HY)=0.100 0 mol·L-1
C. b点时:c(HX)>c(Na+)>c(X-)>c(OH-)>c(H+)
D. 当V(NaOH)=20.00 mL时,NaX、NaY两溶液中的阴离子总数相对大小:N前者>N后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
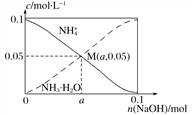
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A. 标准状况下,22.4L NO与11.2 LO2充分反应后分子总数小于NA
B. 1molNa2O2与足量水反应转移电子数为NA
C. 含2molH2SO4的浓硫酸与足量Cu反应,生成NA个SO2分子
D. 常温常压下,28g N2、CO的混合气体中含有原子的数目等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为:____________;与M同一周期的主族元素中原子半径最小的是(填元素符号)________。
(2)含有元素M的化合物Q是淡黄色固体,写出Q的电子式:______________。
(3)氧化铝溶液与过量氨水反应的离子方程式为____________________________________________;
生成物NH4Cl中存在的化学键类型为_____________________________。
(4)元素X、Y在周期表中位于同一主族,化合物Cu2X和Cu2Y可发生如下转化(其中D是纤维素水解的最终产物):
Cu2X![]() 澄清溶液
澄清溶液![]() 悬浊液
悬浊液![]() Cu2Y(砖红色沉淀)
Cu2Y(砖红色沉淀)
①D的分子式是_____________。
②Cu2Y与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为:_______________________。
③硒(Se)是人体必需的微量元素,与元素Y同一主族,Se原子比Y原子多两个电子层,则Se的原子序数为_________,其最高价氧化物对应的水化物化学式为_____________________。
该族25周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+99.7 kJ mol-1 b.+29.7 J mol-1 c.-20.6 J mol-1 d.-241.8 J mol-1
表示生成1 mol硒化氢反应热的是___________(填字母代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com