
【题目】将CO2转化为甲醇可以有效利用资源,同时又可控制温室气体.原理为:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
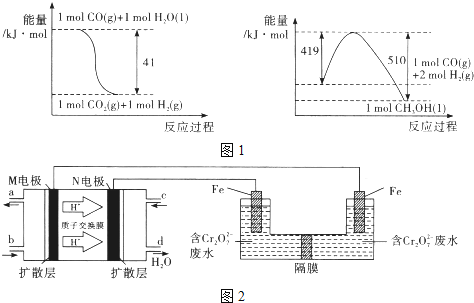
(1)由图1所示的能量变化,写出将CO2转化为甲醇的热化学方程式_____________。
(2)一定温度下,若上述制备甲醇的反应在体积为2L的密闭容器中进行并保持温度不变,起始时投入1moICO2、4molH2,达到平衡时H2与CO2的物质的量之比为8 :1 , CO2的转化率是_____________.
(3)以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含Cr2O72-)时,实验室利用图2装置模拟该法:
①M区发生反应的电极反应式为___________。
②己知电解池溶液里以Cr2O72-转化为Cr3+,该反应的离子方程式________________。
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当Cr3+沉淀完全,溶液的pH_______________。(己知Ksp[Cr(OH)3]=6.4×10-31,lg2=0.3) 。
【答案】(1)CO2(g)+3H2(g)=CH3OH(g)+H2O(l) △H=-50kJ/mol;
(2)80%;
(3)①CH3OH+H2O+6e-=CO2↑+6H+;②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)5.6;
【解析】
试题分析:(1)根据图1中能量变化,可得热化学方程式为:
①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,
②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,
根据盖斯定律,②-①可得:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
(2)假设转化的CO2为xmol,由方程式可知转化的氢气为3xmol,故平衡时CO2为(1-x)mol、氢气为(4-3x)mol,平衡时H2与CO2的物质的量之比为8:1,则(4-3x):(1-x)=8:1,解得x=0.8,故CO2的转化率是![]() ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,电极反应式为:CH3OH+H2O-6e-═CO2↑+6H+,故答案为:CH3OH+H2O-6e-═CO2↑+6H+;
②电解池溶液里Cr2O72-转化为Cr3+,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,同时生成水,反应离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)溶液中c(Cr3+)=l0-5mol/L时沉淀完全,Ksp[Cr( OH)3]=c(Cr3+)×c3(OH-)=6.4×l0-31,则溶液中c(OH-)=4×l0-9,故溶液中c(H+)=![]() mol/L=2.5×l0-6mol/L,则pH=-lgc(H+)=5.6,故答案为:5.6。
mol/L=2.5×l0-6mol/L,则pH=-lgc(H+)=5.6,故答案为:5.6。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.三氧化硫的水溶液能导电,所以三氧化硫是电解质
B.自由移动离子数目多的电解质溶液导电能力不一定强
C.硫酸氢钠晶体中有自由移动的
D.甲烷属于非电解质,但其水溶液能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.B.C.D.E.F六种短周期元素的原子序数依次增大。已知A.C.F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A___________,D___________,E___________;
(2)用电子式表示B、F形成的化合物___________;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式_____________;
(4)D的固态氧化物是________晶体。含n mol D的氧化物的晶体中含D-O共价键为_______mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A.CH3CH2CH=CHCH2CH3不存在顺反异构体。
B.分子式为C5H10O2的羧酸有8种
C.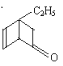 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种
的属于芳香族化合物的同分异构体中不与金属钠反应的有5种
D.棱晶烷![]() 为正三棱柱形,它的二氯代物有5种
为正三棱柱形,它的二氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NC13) 。氯胺消毒时首先发生水解,生成具有强烈杀菌作用的次氯酸。
(2) NH2Cl中氯元素的化合价为_______,其电子式为________。
(2) NH2Cl水解的离子方程式为____________。
(3)三氯胺在常温下为黄色黏稠的油状液体,有毒,在弱酸性溶液中稳定性较好。将0.01mol NCl3通入100mL0.5mol/LNa2SO3溶液中,转移电子的物质的量为___________。
(4)已知:
2NH3(g)+ 3Cl2(g)=N2(g)+ 6HCl(g) △H1=-469kJ·mol-1
N2(g)+ 3Cl2(g)=2NC13(g) △H2=+520kJ·mol-1
NH3(g)+3Cl2(g)=NC13(g)+3HCl(g) △H3
则△H3=_________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中正确的是( )。
A.若t1=15 s,则用A的浓度变化表示的t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.该容器的容积为2 L,B的起始物质的量为0.02 mol
C.t4~t5阶段改变的条件一定为减小压强
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:3A(g) ![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________;
(2)M分子中C原子轨道的杂化类型为__________________;
(3)E+的核外电子排布式为__________________1s22s22p63s23p63d10
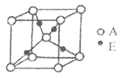
,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________;
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________;
(5)写出与CA2互为等电子体的B3-的结构式 __________________;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com