
【题目】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中正确的是( )。
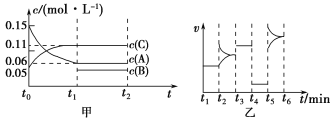
A.若t1=15 s,则用A的浓度变化表示的t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.该容器的容积为2 L,B的起始物质的量为0.02 mol
C.t4~t5阶段改变的条件一定为减小压强
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:3A(g) ![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
【答案】C
【解析】
试题分析:A、若t1=15s,A在t0~t1阶段的平均反应速率=(0.15-0.06)/15=0.006 mol·L-1·s-1,A错误;B、反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11 mol/L -0.05 mol/L =0.06 mol/L,反应中A与C的化学计量数比值为0.09:0.06=3:2,t3~t4阶段正逆反应速率相等,为使用催化剂,t4~t5阶段正逆反应速率相等,则为减小压强,则该反应中气体的化学计量数之和前后相等,则有3A(g)![]() B(g)+2C(g),根据方程式分析消耗0.09 mol/L的A生成0.03 mol/L的B,容器的体积为2升,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,B错误;C、如t4~t5阶段改变的条件为降低温度,平衡移动,则正反应和逆反应速率不相等,所以应为降压,C正确;D、反应方程式为3A(g)
B(g)+2C(g),根据方程式分析消耗0.09 mol/L的A生成0.03 mol/L的B,容器的体积为2升,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,B错误;C、如t4~t5阶段改变的条件为降低温度,平衡移动,则正反应和逆反应速率不相等,所以应为降压,C正确;D、反应方程式为3A(g)![]() B(g)+2C(g),A的物质的量减少0.06mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为50akJ,根据图像分析,t5~t6阶段为升温,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为:3A(g)
B(g)+2C(g),A的物质的量减少0.06mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为50akJ,根据图像分析,t5~t6阶段为升温,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为:3A(g)![]() B(g)+2C(g)ΔH=+50a kJ·mol-1,D错误,答案选C。
B(g)+2C(g)ΔH=+50a kJ·mol-1,D错误,答案选C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知反应:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
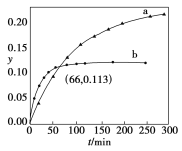
A.b代表0℃下CH3COCH3的Y-t曲线
B.反应进行到20min末,CH3COCH3的![]() >1
>1
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的![]() =1
=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5·H2O和Fe3O4。
(1)铁元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。
(2)以硼酸为原料可制得NaBH4 ,B原子的杂化方式为 。
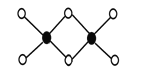
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“否”)平面型分子。
(4)Al单质为面心立方晶体,其晶胞的边长a=0.405nm,列式表示Al单质的密度:_________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得。
(1)氨气的发生装置可以选择下图中的_______,反应的化学方程式为__________________。
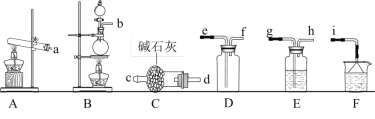
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_______(按气流方向,用小写字母表示)。
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如下实验(填写表中空白):
实验操作 | 实验现象及结论 |
将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
(4)小明将滴有酚酞的稀氨水加热,观察到溶液颜色变浅,原因可能是 。
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化。为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①﹥②,则稀盐酸经加热煮沸后浓度 (填“增大”、“减小”或“不变”)。为除去氯化钠溶液中的碳酸钠,小林设计了如下方案:
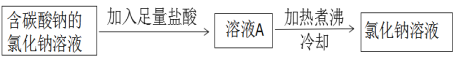
你认为上述方案 (填“合理”或“不合理”),请分析: (如合理,说明原因;如不合理,说明原因并设计改进方案)。
(6)为研究氨气的还原性,小兰做了一下实验:将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
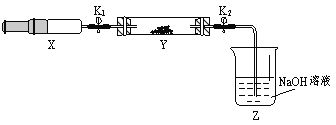
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中___________ | ②反应的化学方程式 ______________________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③___________________ | ④____________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇可以有效利用资源,同时又可控制温室气体.原理为:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
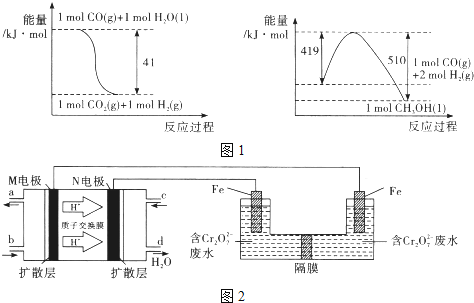
(1)由图1所示的能量变化,写出将CO2转化为甲醇的热化学方程式_____________。
(2)一定温度下,若上述制备甲醇的反应在体积为2L的密闭容器中进行并保持温度不变,起始时投入1moICO2、4molH2,达到平衡时H2与CO2的物质的量之比为8 :1 , CO2的转化率是_____________.
(3)以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含Cr2O72-)时,实验室利用图2装置模拟该法:
①M区发生反应的电极反应式为___________。
②己知电解池溶液里以Cr2O72-转化为Cr3+,该反应的离子方程式________________。
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当Cr3+沉淀完全,溶液的pH_______________。(己知Ksp[Cr(OH)3]=6.4×10-31,lg2=0.3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有水果香味的中性物质A可以发生下列变化:
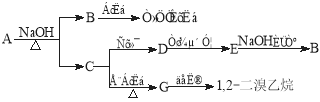
(1) 其中的弱酸是_____________________,G的结构简式为___________
(2) 写出下列变化的方程式:
A+NaOH→B+C的化学方程式:_____________________________________________
C→D的化学方程式:__________________________________________
D的银镜反应的离子方程式:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+ 2B(g)![]() 4C(g)+ D(g)△H>0,在一定温度、压强下达到平衡。平衡时C的物质的量与通入B的物质的量的变化关系如图所示。下列说法正确的是:( )
4C(g)+ D(g)△H>0,在一定温度、压强下达到平衡。平衡时C的物质的量与通入B的物质的量的变化关系如图所示。下列说法正确的是:( )
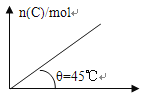
A.平衡时B的转化率为20%
B.若再通入B,则再次达平衡时C的体积分数增大
C.在容器中加入催化剂,则B的转化率增大
D.若保持压强一定,当温度升高时,图中θ>45°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
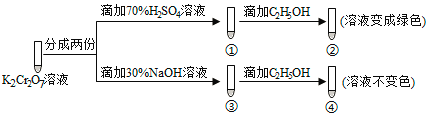
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com