某学生取纯净的Na2SO3?7H2O 50.00g,在密闭容器中经6000C以上的强热至恒重,分析及计算表明,恒重后的样品质量相当于无水亚硫酸钠的计算值,而且各元素的组成也符合计算值,但将它溶于水,却发现溶液的碱性大大高于同时配制的亚硫酸钠溶液.经过他的实验和思考,这位同学解释了这种反常现象.
(1)他将恒重后的样品溶于水配成溶液,为加速溶解,可采取______的措施,观察发现样品全部溶解,溶液澄清.
(2)取少量(1)中所配溶液,加入足量的用______ (填一种酸)酸化的氯化钡溶液有白色沉淀,说明产物中含有______(填离子符号).
(3)另取少量(1)中所配溶液于试管中,滴加少量盐酸,看到气泡产生,通过______方法闻到臭鸡蛋气味,说明生成______气体,写出生成该气体的离子反应方程式:______;同时发现溶液变浑浊,原因是:(用离子方程式表示)______.
(4)根据以上实验,该同学经分析解释了以上实验中的反常现象,请你用一个化学方程式表示:______.这一反应在上述实验中______(填“是”或“否”)能确定反应完全.
解:(1)加速固体的溶解,可用搅拌或加热的方法,故答案为:搅拌或加热;
(2)检验是否有SO42-,应先加入盐酸,如无现象,然后加入氯化钡溶液观察是否有沉淀生成,故答案为:盐酸;SO42-;
(3)硫化氢有毒,闻气体时应在瓶口用手轻轻扇动,使少量气体飘进鼻孔,即招气入鼻的方法,
硫化氢气体有臭鸡蛋气味,生成H2S气体的离子反应方程式为S2-+2H+=H2S↑,SO32-可与S2-发生氧化还原反应生成单质硫,反应的离子方程式为SO32-+2S2-+6H+=3S↓+3H2O,
故答案为:招气入鼻;H2S;S2-+2H+=H2S↑;SO32-+2S2-+6H+=3S↓+3H2O;
(4)由题意可知亚硫酸钠分解生成硫酸钠和硫化钠,反应的方程式为4Na2SO3=3Na2SO4+Na2S,由(3)可知,亚硫酸钠没有完全分解,故答案为:4Na2SO3=3Na2SO4+Na2S;否.
分析:(1)加速固体的溶解,可用搅拌或加热的方法;
(2)如加入盐酸酸化的氯化钡溶液生成生成,说明溶液中含有硫酸根离子;
(3)硫化氢有毒,闻气体时应在瓶口用手轻轻扇动,使少量气体飘进鼻孔,硫化氢气体有臭鸡蛋气味,SO32-可与S2-发生氧化还原反应生成单质硫;
(4)由题意可知亚硫酸钠分解生成硫酸钠和硫化钠.
点评:本题考查亚硫酸钠分解产物探究,注意根据实验现象判断生成物,把握常见基本实验操作方法,为解答该题的关键,题目难度中等.



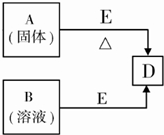 则:
则:
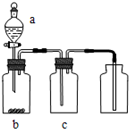 用图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
用图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是