

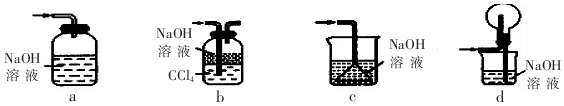
分析 黄铜矿在空气中焙烧后生成Cu2O、Cu、SO2以及熔渣,然后由Cu2O、Cu制得粗铜最终制得CuSO4•5H2O,所以X是SO2,
(1)气体X是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,二氧化硫是酸性氧化物,结合选项中各物质的性质以及溶解度大小判断;
(2)Fe2O3中含有FeO,用稀酸(非氧化性)将熔渣溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,可利用KMnO4溶液褪色来证明;
(3)当硝酸根离子恰好反应时硫酸和硝酸的物质的量之比最佳,根据离子方程式计算即可;
(4)根据反应方程式及滴定数据计算出硫酸铜的物质的量,再计算出硫酸铜晶体的质量分数;根据CuSO4•5H2O质量分数的表达式分析误差;滴定管需要润洗,据此解答即可.
解答 解:黄铜矿在空气中焙烧后生成Cu2O、Cu、SO2以及熔渣,然后由Cu2O、Cu制得粗铜最终制CuSO4•5H2O,所以X是SO2,
(l)a、导管未插入液面以下,不能起到吸收作用,故a错误;
b、氢氧化钠可以吸收二氧化硫,且二氧化硫溶解度较大,先通入到四氯化碳溶液中,起到缓冲气流的作用,能防止倒吸,故b正确;
c、二氧化硫溶解度较大,倒扣的漏斗伸入液面以下,不能起到防倒吸的作用,故c错误;
d、倒扣的圆底烧瓶起到安全瓶的作用,能防止倒吸,故d正确;
故答案为:ac;
(2)Fe2O3中含有FeO,用稀酸(非氧化性)将熔渣溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,KMnO4溶液褪色,则选择试剂为稀硫酸、KMnO4溶液,操作为取少量固体溶于稀硫酸,然后滴加KMnO4溶液,观察到溶液使KMnO4溶液褪色,则证明含有FeO;
故答案为:取少量熔渣装入试管中,加入稀硫酸溶解,再向溶液中滴人高锰酸钾溶液,若溶液紫色褪去,可证明熔渣中含有Fe0;
(3)当硝酸根离子恰好反应时硫酸和硝酸的物质的量之比为最佳,由离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 可知,反应中消耗2molNO3-,需要8molH+,硝酸电离2mol,另外6mol氢离子由硫酸提供,则硫酸为3mol,所以硝酸与硫酸的物质的量之比为2:3;
故答案为:2:3;
(4)根据CuSO4•5H2O~Cu2+~H2Y2-可知20.00mL溶液中n(CuSO4•5H2O)=n(EDTA)=c×b×10-3mol;
所以m(CuSO4•5H2O)=c×b×10-3mol×250g/mol=0.25bc g,
因此100mL溶液中CuSO4•5H2O的质量为:0.25bc×5=1.25bcg,所以ω=$\frac{1.25bc}{a}×100%$=$\frac{125bc}{a}%$;
滴定管需要用所盛装溶液润洗,否则会稀释标准液的浓度,导致标准液使用偏多,结果偏高;
故答案为:$\frac{125bc}{a}%$;偏高.
点评 本题考查金属混合物的分离和提纯,涉及尾气处理、离子的检验、氧化还原反应的方程式书写以及滴定实验,关键是提取题中的信息,根据所学知识完成,本题难度中等.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Ca2+、HCO3-、Cl- | B. | Fe2+、Ca2+、Cl-、NO3- | ||
| C. | K+、Fe2+、SO42-、Br- | D. | Na+、K+、SO42-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
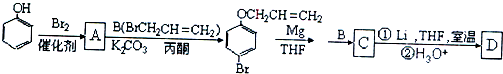
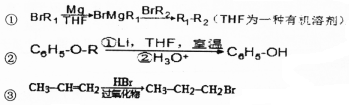
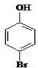 、
、 .
. 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境. 的有机反应类型取代反应.
的有机反应类型取代反应. .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| B. | 用食醋除去水壶内的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | KHCO3与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++ClO-+H2O═MnO2↓+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X有多种同素异形体,而Y不存在同素异形体 | |
| B. | X、M均能与氯形成由极性键构成的XCl4、MCl4分子 | |
| C. | W的氧化物对应的水化物可与Z的最高价氧化物对应的水化物反应 | |
| D. | 离子半径大小:r(Y2-)>r(W3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将乙醛加入含有新制银氨溶液的试管中,于沸水浴中加热来制得银镜 | |
| B. | 称量12.5gCuSO4•5H2O,配成100mL溶液,得到0.5mol/L的CuSO4溶液 | |
| C. | 用图1装置检验实验室制得的乙烯中混有SO2和CO2 | |
| D. | 利用图2装置从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com