
| A. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| B. | 用食醋除去水壶内的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | KHCO3与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++ClO-+H2O═MnO2↓+Cl-+2H+ |
分析 A.氯气过量,二价铁离子、溴离子完全被氧化;
B.醋酸为弱酸,应保留化学式;
C.氢氧化钙足量,反应生成碳酸钙、氢氧化钾和水;
D.碱性溶液中不可能生成氢离子.
解答 解:A.向FeBr2溶液中通入过量的Cl2,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故A错误;
B.用食醋除去水壶内的水垢,离子方程式:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO-,故B错误;
C.KHCO3与足量澄清石灰水反应,离子方程式:HCO3-+Ca2++OH-═CaCO3↓+H2O,故C正确;
D.强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2,离子方程式:ClO-+Mn2++2OH-=MnO2+Cl-+H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,题目难度中等,明确物质的性质,反应的实质是解题关键,注意反应物用量对反应的影响,注意化学式的拆分.


科目:高中化学 来源: 题型:选择题
| A. | C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | Cl2+SO2+H2O=H2SO4+2HCl | D. | 2F2+2H2O=4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
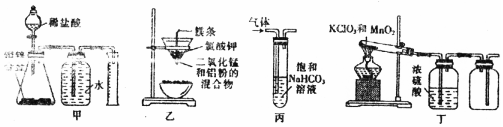
| A. | 装置甲:测定合金中Zn的含量 | B. | 装置乙:制取金属锰 | ||
| C. | 装置丙:洗气除去SO2中的CO2 | D. | 装置丁:实验室制取O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液的导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

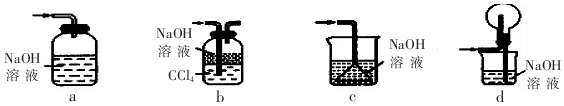
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性P<S | |
| B. | H3PO4溶液的导电能力弱于H2SO4溶液 | |
| C. | Na3PO4溶液呈碱性,Na2SO4溶液呈中性 | |
| D. | H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明氧化性:H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| B | 鉴别溴蒸气和NO2 | 分别通入硝酸银溶液中,产生淡黄色沉淀的是溴蒸汽 |
| C | 证明盐类水解是吸热反应 | 在醋酸钠溶液中滴入酚酞试液,加热后红色加深 |
| D | 证明难溶物存在沉淀溶解平衡 | 往黄色固体难溶物PbI2加水中振荡,静置取上层清液加入 NaI固体产生黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com