
| A. | 一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液的导电能力 |
分析 A.物质的体积由微粒间的平均距离、微粒的大小以及微粒的数目决定;
B.碱性氧化物一定为金属氧化物,而金属氧化物不一定为碱性氧化物,如过氧化钠不属于碱性氧化物;
C.一元酸、二元酸是根据酸电离出氢离子的个数进行分类的;
D.溶液的导电能力与离子浓度成正比,与电解质的强弱无关.
解答 解:A.影响物质体积大小的因素:微粒间的平均距离、微粒的大小以及微粒的数目,其中影响固体液体体积大小的主要因素是微粒的大小,影响气体体积大小的主要因素是微粒间距,故A错误;
B.碱性氧化物对应的水化物为碱,所以碱性氧化物一定是金属氧化物,而金属氧化物不一定是碱性氧化物,如过氧化钠为金属氧化物,但是过氧化钠不属于碱性氧化物,故B正确;
C.一元酸、二元酸是根溶液的导电能力与离子浓度成正比,与电解质的强弱无关,故C错误;
D.据酸电离出氢离子的个数进行分类的,如CH3COOH含有4个H,但为一元酸,故D错误;
故选B.
点评 本题考查物质分类、电解质的强弱与导电能力的关系、物质体积的判断等解答该类概念性题目,应对概念十分清晰.抓住概念中的关键词,是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学研究会造成严重的环境污染,危害人们的生活 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用大量木材作燃料可以缓解当前能源不足问题 | |
| D. | 对于常见的大多数金属,其金属活动性越强,冶炼就越困难 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| B. | 用食醋除去水壶内的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | KHCO3与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++ClO-+H2O═MnO2↓+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
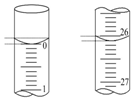 某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定 次数 | 盐酸溶液/mL | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前 | 滴定 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 最合理的方案.
最合理的方案.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com