
【题目】除去下列物质中含有的少量杂质(括号中的物质)的方法,错误的是( )
A.NH4Cl溶液(I2)用CCl4萃取B.NO(NH3)通过水洗涤
C.NH4Cl(NaCl)加热固体混合物D.N2(NO2)通过水洗涤
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A. 晶体熔点的高低:
B. 熔点由高到低:Na>Mg>Al
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳酸钠和碳酸氢钠的说法不正确的是
A.碳酸钠的热稳定性比碳酸氢钠强
B.相同温度时,碳酸钠的溶解度大于碳酸氢钠
C.同温度、同物质的量浓度时,碳酸钠溶液碱性大于碳酸氢钠溶液
D.碳酸氢钠一定条件下可转化为碳酸钠,但碳酸钠不能转化为碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将 Cl2 通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向 Fe2(SO4)3 溶液中加入过量铁粉: Fe3++Fe=2Fe2+
C. 将 SO2 通入双氧水中: SO2+H2O2=2H++SO42-
D. 向 Na2SiO3 溶液中滴加稀盐酸: Na2SiO3+2H+=H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,负极材料采用Pt,正极材料采用MnO2(既作电极材料又对该极的电极反应具有催化作用),该电池可用作卫星、深水勘探等无空气环境电源,其工作原理如图所示。下列说法不正确的是

A. 每消耗3mol H2O2,转移6mol e﹣
B. 电池工作时Na+从b极区移向a极区
C. a极上的电极反应式为:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
D. b极材料是MnO2,该电池总反应方程式:NaBH4 + 4H2O2===NaBO2 + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 25℃时有关弱酸的电离平衡常数:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列有关说法正确的是
A. 1 mol·L-1HCN溶液与1mol·L-1 NaOH溶液等体积混合后,测得所得溶液显酸性
B. 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
C. NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-)
D. 1mol/L醋酸溶液加水稀释,所有离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是
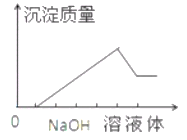
A. Mg2+、Al3+、Fe3+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法不正确的是

A.气体A是NO
B.X中不能确定的离子是 A13+和C1ˉ
C.溶液E和气体F能发生化学反应
D.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A. 0.1 mol·L-1 NH4HS溶液中有:c(NH![]() )<c(HS-)+c(S2-)+c(H2S)
)<c(HS-)+c(S2-)+c(H2S)
B. 25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH![]() )=c(Cl-),则NH3·H2O的电离常数为
)=c(Cl-),则NH3·H2O的电离常数为![]()
C. 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN)
D. 等pH的HA和HB溶液,分别与一定浓度的氢氧化钠溶液完全中和,HA消耗的氢氧化钠溶液体积多,则可证明酸性HA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com