
【题目】下列离子方程式正确的是
A. 将 Cl2 通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向 Fe2(SO4)3 溶液中加入过量铁粉: Fe3++Fe=2Fe2+
C. 将 SO2 通入双氧水中: SO2+H2O2=2H++SO42-
D. 向 Na2SiO3 溶液中滴加稀盐酸: Na2SiO3+2H+=H2SiO3↓+2Na+
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
实验步骤 | 实验操作 |
Ⅰ | 取一定质暈的FeCO3固体置于 中,高温煅烧至质量不再减轻,冷却至室溫 |
Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
(1)Ⅰ中横线处所需的化学仪器为______________________________________。
(2)写出实验步骤Ⅲ中发生反应的离子方程式_____________________________。
(3)乙同学提出不同看法:煅烧产物可能是Fe304,因为Fe304也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是___________________(填序号)。
a.氯水
b.氯水和KSCN溶液
c.酸性高锰酸钾溶液
(4)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是______________________________________。
(5)丙同学进一步査阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、_____________(填名称)和____________(填名称);再___________________(填操作名称),灼烧,即可得到Fe203。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 当光束通过稀豆浆时,会产生丁达尔效应
B. 因为SO2有漂白性,所以它可使高锰酸钾溶液褪色
C. 氯化钠溶液在电流作用下电离成Na+和Cl-
D. 等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸钠产生的CO2多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如图所示,下列叙述不正确的是
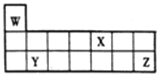
A. 原子半径:Y>Z>W
B. Z的氧化物对应的水化物酸性均比X的强
C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
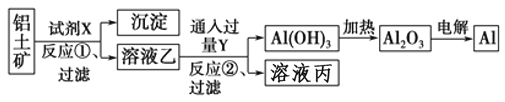
下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢硫酸中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中含有的少量杂质(括号中的物质)的方法,错误的是( )
A.NH4Cl溶液(I2)用CCl4萃取B.NO(NH3)通过水洗涤
C.NH4Cl(NaCl)加热固体混合物D.N2(NO2)通过水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的微粒在指定溶液中一定能大量共存的是( )
A. c(FeCl3)=1.0 mol·L-1的溶液中:HCO![]() 、Cl-、H+、Na+
、Cl-、H+、Na+
B. 常温下,由水电离出的c(H+)=10-14mol·L-1溶液中:NH![]() 、K+、CO
、K+、CO![]() 、SO
、SO![]()
C. 在c(HCO![]() )=0.1 mol·L-1的溶液中:NH
)=0.1 mol·L-1的溶液中:NH![]() 、AlO
、AlO![]() 、Cl-、NO
、Cl-、NO![]()
D. 常温下, 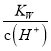 =0.1 mol·L-1的溶液中:K+、NH3·H2O、SO
=0.1 mol·L-1的溶液中:K+、NH3·H2O、SO![]() 、NO
、NO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com