
| A、Na在足量O2中燃烧,消耗l mol O2时转移的电子数是4×6.02×1023 |
| B、盐酸和醋酸的混合溶液pH=1,该溶液中c(H+)=0.1 mol/L |
| C、1 L 0.1 mol/L NH4Cl溶液中的NH4+数是0.1×6.02×1023 |
| D、标准状况下2.24 L Cl2中含有0.2 mol 共价键 |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
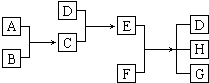 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
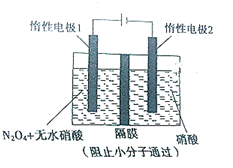 用如图装置电解制备N2O5 ,下列有关说法正确的是( )
用如图装置电解制备N2O5 ,下列有关说法正确的是( )| A、N2O5在惰性电极2处产生 |
| B、在惰性电极2处有氢气产生 |
| C、在惰性电极1处发生还原反应 |
| D、在惰性电极2处有NO产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 NA表示阿伏加德罗常数的值,常温下,抽去图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )
NA表示阿伏加德罗常数的值,常温下,抽去图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )| A、反应前气体的总体积为0.448L |
| B、生成物中含有0.01NA个分子 |
| C、装置中氢元素的总质量为0.04g |
| D、生成物完全溶于水后所得溶液含有0.01 NA个F- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| B、PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C、1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,胶体粒子的数目小于NA |
| D、1.8 g重水(D2O)中含NA个质子和NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01 mol/L的蔗糖溶液 |
| B、0.01 mol/L的K2SO4溶液 |
| C、0.02 mol/L的NaCl溶液 |
| D、0.02 mol/L的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、Cl-、SO42- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、H+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用装置甲制备氨气 |
| B、用装置乙除去氨气中少量水 |
| C、用装置丙收集氨气 |
| D、用装置丁吸收多余的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com