
| 实验操作 | 实现现象 | 结论 | |
| A | 用饱和碳酸钠溶液浸泡锅炉沉积物后,过滤,洗涤,在所得沉淀物中再加入稀盐酸 | 有气泡产生 | 可除去锅炉沉淀物中的CaSO4 |
| B | 某充满NO2的密闭容器中,待反应平衡后,保持温度不变,扩大容器体积 | 气体颜色变浅 | 平衡2NO2(g)?N2O4(g)正向移动 |
| C | 向品红溶液中通入某气体 | 溶液褪色 | 该气体是SO2 |
| D | 用洁净铂丝蘸取溶液置于酒精灯火焰上灼烧 | 火焰呈黄色 | 溶液中含Na+,无K+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.将硫酸钙转化成更难溶的碳酸钙,然后用稀盐酸溶解碳酸钙即可除去硫酸钙;
B.扩大容器容积后压强减小,平衡向着气体体积增大的方向移动;
C.能够使品红溶液褪色的不一定为二氧化硫,可以是氯气、臭氧等;
D.该实验只能证明含有钠离子,无法判断是否含有钾离子.
解答 解:A.硫酸钙不与盐酸反应,所以无法直接用酸除去硫酸钙,可以先用饱和碳酸钠溶液浸泡锅炉沉积物后,硫酸钙沉淀转化成更难溶的碳酸钙,然后过滤,洗涤,在所得沉淀物中再加入稀盐酸,碳酸钙溶解,据此可除去锅炉中的硫酸钙,故A正确;
B.待反应平衡后,保持温度不变,扩大容器体积,容器内压强减小,平衡向着气体体积增大的逆向移动,由于重新达到平衡时二氧化氮减小,导致气体颜色变浅,故B错误;
C.向品红溶液中通入某气体,溶液褪色,说明该气体能够漂白品红溶液,可能为臭氧、氯气,不一定为二氧化硫,故C错误;
D.用洁净铂丝蘸取溶液置于酒精灯火焰上灼烧,火焰呈黄色,证明溶液中含有Na+,无法判断是否含有K+,若检验K+,需要通过蓝色钴玻璃观察,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及难溶物溶解平衡应用、化学平衡及其影响、焰色反应等知识,注意掌握难溶物沉淀转化实质、焰色反应的实验操作方法,B为易错点,注意气体颜色变浅的原因是容器容积扩大所致,试题培养了学生的分析、理解能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
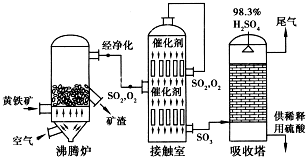
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C12 | B. | NH3 | C. | BaCO3 | D. | C2H5OH (乙醇) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等 | |
| D. | 2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在含4mol Si-O键的二氧化硅中,氧原子数为4NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
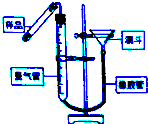 过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.
过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
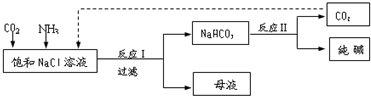
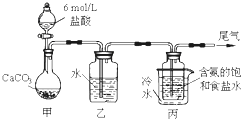
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com