

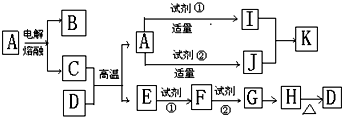
分析 浅黄色固体W和水反应生成溶液B和气体甲,证明W为Na2O2,B为NaOH溶液,甲为O2,固体A和水反应生成气体乙和悬浊液C,固体A是一种可由石灰石来制取的重要工业原料判断A为CaC2,气体乙为C2H2,浊液C为Ca(OH)2,乙炔在氧气中燃烧生成气体丙为CO2,液体E为H2O,气体丙二氧化碳和氢氧化钠溶液反应生成溶液D时二氧化碳和氢氧化钠反应生成的碳酸钠或碳酸氢钠溶液,据此分析回答问题.
解答 解:浅黄色固体W和水反应生成溶液B和气体甲,证明W为Na2O2,B为NaOH溶液,甲为O2,固体A和水反应生成气体乙和悬浊液C,固体A是一种可由石灰石来制取的重要工业原料判断A为CaC2,气体乙为C2H2,浊液C为Ca(OH)2,乙炔在氧气中燃烧生成气体丙为CO2,液体E为H2O,气体丙二氧化碳和氢氧化钠溶液反应生成溶液D时二氧化碳和氢氧化钠反应生成的碳酸钠或碳酸氢钠溶液,
(1)固体A是一种可由石灰石来制取的重要工业原料,结合反应现象判断为CaC2,由石灰石制取A过程中的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO;
(2)工业上曾利用C为Ca(OH)2,来制取B为NaOH溶液,在制取过程中还需加入一种物质是碳酸钠,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,
故答案为:Na2CO3;
(3)上述变化中生成的C和过量的丙恰好能完全反应.该反应的化学方程式为Ca(OH)2+2CO2=Ca(HCO3)2,
故答案为:Ca(OH)2+2CO2=Ca(HCO3)2;
(4)W为过氧化钠与水反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2 ↑,
故答案为:2Na2O2+2H2O=4NaOH+O2 ↑.
点评 本题考查了无机物的性质推断、物质转化关系分析、反应现象的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 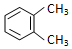 与 与 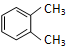 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟,说明苯组成中含碳量较高 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL溴的四氯化碳溶液,振荡后静置,可观察到液体分层,上层呈橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,乙烯对水果具有催熟功能.
,乙烯对水果具有催熟功能.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
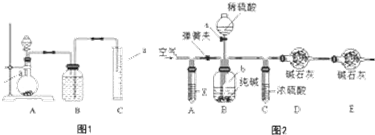
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的平均消耗速率为0.3mol/(L•min) | |
| B. | 升高温度时,v正减小,v逆增大 | |
| C. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| D. | 平衡后,增大压强,平衡将向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 事 实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解, | 证明Na2SO3已氧化变质 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ②⑤ | B. | ①② | C. | ④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实现现象 | 结论 | |
| A | 用饱和碳酸钠溶液浸泡锅炉沉积物后,过滤,洗涤,在所得沉淀物中再加入稀盐酸 | 有气泡产生 | 可除去锅炉沉淀物中的CaSO4 |
| B | 某充满NO2的密闭容器中,待反应平衡后,保持温度不变,扩大容器体积 | 气体颜色变浅 | 平衡2NO2(g)?N2O4(g)正向移动 |
| C | 向品红溶液中通入某气体 | 溶液褪色 | 该气体是SO2 |
| D | 用洁净铂丝蘸取溶液置于酒精灯火焰上灼烧 | 火焰呈黄色 | 溶液中含Na+,无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com