
下列有关实验操作说法中,正确的是
①用pH试纸测得氯水的pH为2
②用量筒、试管胶头滴管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的硫酸和醋酸
③在进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快速率,可用玻璃棒不断搅拌过滤器中液体
A.①③⑤ B.②③⑤ C.③④⑤ D.①③④⑥
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
写出下列反应的化学方程式
⑴乙烯和溴的四氯化碳溶液的反应_______________ ___________ 。
⑵乙醇与红热的铜丝反应得到乙醛 。
⑶乙酸乙酯与氢氧化钠反应_________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
可用来鉴别己烯、甲苯、乙酸乙酯和苯酚溶液的一组试剂是 ( )
A. 溴水、氯化铁溶液 B. 溴水、酸性高锰酸钾溶液
C. 溴水、碳酸钠溶液 D. 氯化铁溶液、酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是
①透明溶液中:K+、Fe3+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、Br-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ca2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、Cl-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 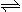 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
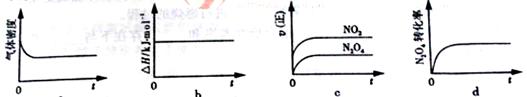
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____ (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1mol某有机物含碳原子n mol,在恰好完全燃烧时只生成CO2和H2O,耗氧气1.5n mol,则对该有机物的说法正确的是( )
①该有机物分子可能含2个氧原子
②该有机物可能使溴的四氯化碳溶液褪色
③若该有机物能与金属钠反应,则分子中的碳氢关系符合CnH2n+2
④若该有机物不能与金属钠反应,则分子中的碳氢关系一定符合CnH2n
A.①② B.②③ C.③④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
研究物质性质的基本程序是一个系统过程,其基本程序一般分为四个过程。下列是研究物质性质基本程序的第一步的是
A.预测物质的性质 B.观察物质的外观性质
C.进行实验和观察 D.作出相关的解释和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.0 g NaOH固体溶于水配成100mL溶液,其密度为
0.20g/mL。
(1)该溶液中NaOH 的物质的量浓度为
(2)该溶液中NaOH的质量分数为
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为 ,含NaOH的质量为 。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修3:物质结构与性质](15分) 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有________个未成对电子,Fe3+的电子排布式为______________________________,可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为______________,1 mol乙醛分子中含有的σ键的数目为____________。乙酸的沸点明显高于乙醛,其主要原因是__________________________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度________________________________________________________________________g·cm-3
(不必计算出结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com