
某固体混合物可能由Al2(NH4)2SO4、MgCl2、FeCl2、AlC13中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是

A.一定含有Al,其质量为4.5g
B.一定不含FeCl2,可能含有MgCl2和AIC13
C.一定含有MgCl2和FeCl2
D.一定含有(NH4)2SO4和MgCl2,且物质的量相等
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列条件下,对应离子一定能大量共存的是
A.在0.1mol/LNa2CO3 溶液中:Al3+、NH4+、SO42-、NO3-
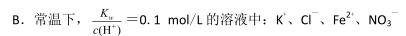
C.使甲基橙变红的溶液中:NH4+、Cl-、SO42-、Mg2+
D.25℃时,水电离出的 c(H+)=1×l0-l3 mol/L 的溶液中:K+、Ba2+、NO3-、S2-
查看答案和解析>>
科目:高中化学 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:填空题
钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:
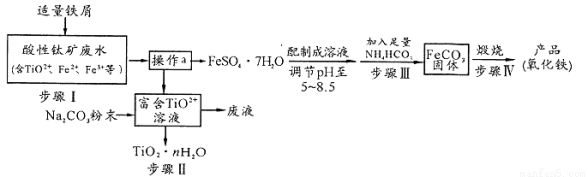
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是 。
(3)操作a是蒸发浓缩、冷却结晶、 。
(4)步骤Ⅲ中发生反应的化学方程式为____________;反应温度一般需控制在35℃以下,其目的是 。
(5)已知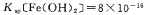 s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因 。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市高三上学期一检化学试卷(解析版) 题型:选择题
某溶液中含有大量的 K+、Cl- 及 X与 Y两种离子,现向该溶液加入 W试剂,根据实验现象得到的关于X、 Y离子的推断能成立的是
W试剂 | 实验现象 | X、Y离子的推测 | |
A | KI—淀粉溶液 | 溶液变蓝 | Fe3+、SO42— |
B | 用pH试纸检测 | pH=7(常温) | CH3COO—、Na+ |
C | 硝酸酸化的AgNO3溶液 | 白色沉淀 | CO32—、NH4+ |
D | 过量NaOH溶液 | 无明显现象 | Al3+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:推断题
分(I)A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素.F与G位置相邻.G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)A与D形成的18电子的化合物与FD2化合生成一种强酸,写出该强酸酸式钠盐水溶液的电离方程式为:________________。
(2)用电子式表示化合物E2D的形成过程:________________。
(3)在l0lkPa、25℃下,14g气态B2A4在D2中完全燃烧,放出QkJ热量,则B2A4的燃烧热的热化学方程式为:________________。
(Ⅱ)A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)
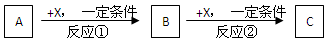
试同答:
(4)若X是强氧化性单质,则A不可能是___________。
a.H,S b. NH3c.Na d.Zn e.CH3CH2OH
(5)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C的化学式为________________。
(6)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为______________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省郴州市高三上第二次教学质量监测化学卷(解析版) 题型:选择题
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 将SO2通入BaCl2溶液,然后滴入稀硝酸 | 白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化BaSO4 |
B | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
C | 向FeCl2溶液中加入足量FeI2出现红褐色沉淀和无色气体 | 出现红褐色沉淀和无色气 | FeCl2溶液部分变质 |
D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:填空题
元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡: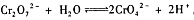 。在实际工业生产中,加入沉淀剂BaCl
。在实际工业生产中,加入沉淀剂BaCl 2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
Ⅱ.还原沉淀法
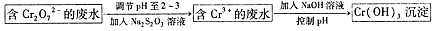
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号)
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后 (填“能”或“否”)直接排放
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路 通过的电子的物质的量为 mol
通过的电子的物质的量为 mol
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,设计正确且能达到实验目的的是 ( )
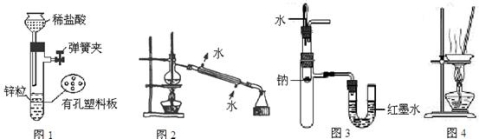
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3 溶液和CH3COOC2H5的混合物
C.用图3所示装置验证Na和水反应的热效应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一12月月考化学试卷(解析版) 题型:选择题
下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
A.NaOH 和AlC13 B.稀盐酸和NaHCO3
C.CaCl2和K2CO3 D.Ba(OH)2和NaHSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com