
钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过程如下: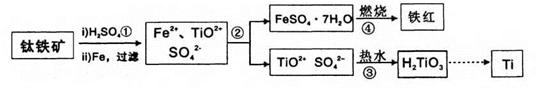
已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、 (填操作名称);步骤④在实验室中常将试剂置于 (填仪器名称)中加强热。
(2)步骤③中加入热水的作用是 。
(3)步骤④中硫酸亚铁晶体(FeSO4·7H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式: 。
(4)步骤②所得到的硫酸亚铁晶体(FeSO4·7H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeO·FeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO4·7H2O的质量应为废水中六价铬(相当于CrO3)质量的 倍。
(共13分)
(1)过滤 (2分) 坩埚 (2分)
(2)加热、稀释有利于促使TiO2+水解生成H2TiO3(2分)
(3)4FeSO4·7H2O+O2 2Fe2O3+4SO3+28H2O (3分)
2Fe2O3+4SO3+28H2O (3分)
(4) 13.9 (4分)
解析试题分析:工艺流程题解题的关键是搞清加入什么物质,发生什么反应,如何分离,要将工艺的流程转化为物质的流程。首先在钛铁矿和Fe2O3中加入H2SO4溶解,再加入Fe进行还原,将Fe3+转化为Fe2+,然后通过冷却、结晶、过滤得到FeSO4·7H2O固体以及滤液,在滤液中加入热水,促使TiO2+发生水解生成H2TiO3,最后转化为Ti。
(4)FeO·FeyCrxO3中,Cr为+3价,Fe为+3价,故x+y=2,根据电子得失守恒有Fe:Cr=3:1,可以设x=0.5,y=1.5;可以得出量的关系为2.5FeSO4·7H2O~0.5CrO3,故质量比为(2.5×278):0.5×100=13.9。
考点:本题以工艺流程为基础,考查了元素及化合物、化学实验基本操作、氧化还原反应及化学计算等相关知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
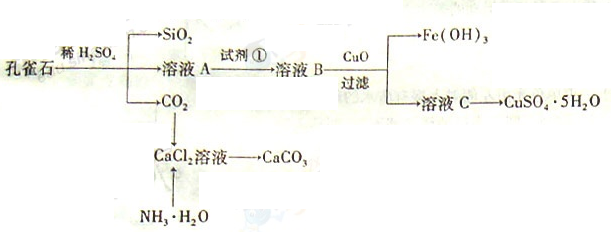
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式),若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。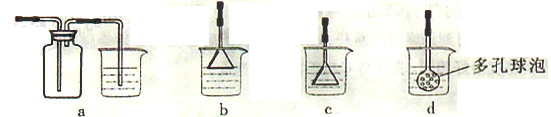
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 ,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:
① 试剂①宜选用石灰乳且必须过量,过量的目的是 .
② 镁蒸气宜在 (填序号)气体冷却后得到镁锭
| A.N2 | B.CO2 | C.Ar | D.空气) |


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| | Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | | | | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
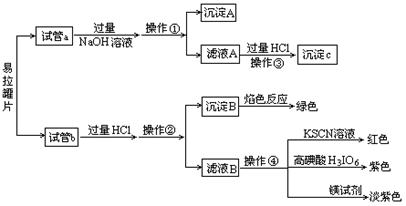
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室可以用MgCl2?6H2O为原料制备碳酸镁晶须,主要流程如下:
试回答:
(1)操作1的名称是_______。
(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成Mg(OH)2,其原因是_____________________。
(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg5(OH)2(CO3)4·4H2O,写出该反应的化学方程式______________。
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下研究。(注:Mg(OH)2, Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容。
| 实验步骤 | 预期的实验现象和结论 |
| 取一定质量的固体样品 | 若 ,则固体产物为Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按右表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象。
| 实验 | P2O5 /g | 95%乙醇量/ mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
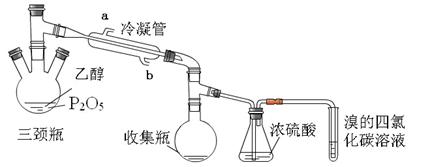
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 | 有无色液体 | 溶液不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
|

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2CH2OH;CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)写出实验室制备氢气的化学方程式: 。
(2)若用以上装置制备干燥纯净的CO,装置中b的作用分别是 ; C中盛装的试剂是 。若用以上装置制备H2,在虚线框内画出收集H2干燥的装置图。
(3)制丙烯时,还产生少量SO2, CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①足量饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)下图所示装置工作时均与H2有关。
①图1所示装置中阳极的电极反应式为 。
②图2所示装置中,通入H2的管口是 (选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论 (填“严密”或“不严密”),你的理由是 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
煅烧硫酸镁的过程中存在以下反应:
利用下图装置对煅烧产生的气体进行分步吸收或收集。
|
|

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com