
【题目】碳及其化合物在生产和生活中有重要意义。海水中CO2的吸收能力取决于溶解的碳酸盐和硼酸盐生成的CO32-和B(OH)4-浓度。已知:298K时,H3BO3+H2O![]() H++B(OH)4-,Ka=5.7×10-10,碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
H++B(OH)4-,Ka=5.7×10-10,碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
(1)298K时,相同浓度的碳酸钠溶液和硼酸钠溶液,pH较大的是_______溶液。
(2)少量CO2与B(OH)4-反应的离子方程式为___________。
(3)采用高温熔融混合碳酸盐LiaNabKcCO3作电解质吸收并电解CO2制得无定型炭是CO2 资源化利用的一种新途径。此法的阴极电极反应式为________。
【答案】碳酸钠 CO2+B(OH)4-=HCO3-+H3BO3 3CO2+4e-=C+2CO32-
【解析】
(1)根据形成盐的酸的酸性越弱,等浓度时相应的酸根离子水解程度越大,溶液的碱性越强分析;
(2)根据复分解反应规律书写离子方程式;
(3)电解吸收CO2,在阴极CO2得到电子变为C单质,同时产生CO32-,据此书写阴极电极反应式。
(1)根据电离平衡常数大小可知:酸性:H2CO3>H3BO3>HCO3-,所以在298K时,相同浓度的碳酸钠溶液和硼酸钠溶液,CO32-水解程度比较大,最终达到平衡时溶液pH较大的是碳酸钠;
(2)由于酸性:H2CO3>H3BO3>HCO3-,少量CO2与B(OH)4-反应的离子方程式为CO2+B(OH)4-=HCO3-+H3BO3;
(3)采用高温熔融混合碳酸盐LiaNabKcCO3作电解质,吸收并电解CO2制得无定型炭是CO2 资源化利用的一种新途径,此法中CO2在阴极得到电子变为C单质,同时得到CO32-,阴极电极反应式为3CO2+4e-=C+2CO32-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
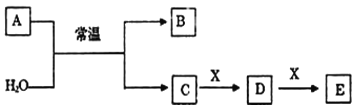
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
(2)若A为淡黄色粉末,X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为___(填代号)。
A.盐酸 B.BaCl2溶液 C.Ca(OH)2溶液
(3)若A为非金属氧化物,B为气体,遇空气会变红棕色,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式中,正确的是( )
A.醋酸的电离方程式:CH3COOH → CH3COO一+ H+
B.常温下NH4Cl溶液的pH < 7
C.因为SO3的水溶液能够导电,所以SO3是强电解质
D.在常温下的NaOH溶液中,由于NaOH抑制了水的电离,水的离子积常数(KW)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 0.1000 mol·L1盐酸中滴加0.1000 mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5。下列说法不正确的是
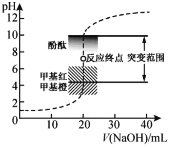
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用移液管量取20.00 mL 0.1000 mol·L1盐酸时,移液管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00 mL 时,pH约为1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)下列各组中的两种有机物,可能是:(A)相同的物质,(B)同系物,(C)同分异构体。请判断它们之间的关系(用A、B、C填空)
①2-甲基丁烷和丁烷__,
②正戊烷和2,2-二甲基丙烷__,
③对二甲苯和1,4—二甲苯__,
④1-已烯和环已烷__。
(2)![]() 的名称__。
的名称__。
(3)写出A的分子式:__。
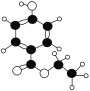
(4)A能够发生反应的类型有(填序号):__。
①氧化反应;②加成反应;③取代反应;④消去反应
(5)写出A与烧碱溶液反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知C(s,金刚石)=C(s,石墨) △H<0,则金刚石比石墨稳定
B.已知2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1,则CO的燃烧热为566.0kJ·mol-1
C.已知C(s,石墨)+O2(g)=CO2(g) △H=akJ·mol-1,C(s,石墨)+![]() O2(g)=CO(g) △H=bkJ·mol-1,则a>b
O2(g)=CO(g) △H=bkJ·mol-1,则a>b
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,则含lmolNaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g)![]() CH3OH (g)。
CH3OH (g)。
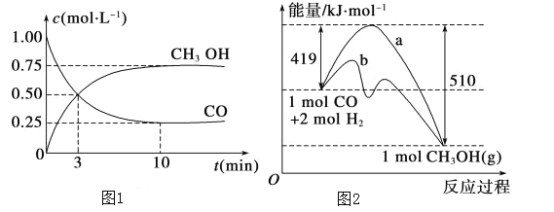
(1)该反应的平衡常数表达式为:K=______________________
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)=____________。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是________(填“吸热”或“放热”)反应,反应的热化学方程式是__________________________________________。
(4)适宜的催化剂能_______(选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有________(选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
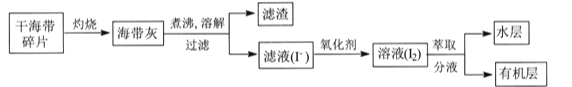
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应N2(g)+3H2(g)![]() 2NH3(g),达到平衡的标志是
2NH3(g),达到平衡的标志是
①反应速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2;②各组分的物质的量浓度不再改变;③体系的压强不变;④混合气体的密度不变 (相同状况);⑤体系的温度不再发生变化;⑥2 v(N2)(正)=v(NH3)(逆) ;⑦单位时间内有3mol H—H断裂同时有2mol N—H断裂。
A.①②③⑤⑥⑦B.②③④⑤⑥C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com