
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g)![]() CH3OH (g)。
CH3OH (g)。
(1)该反应的平衡常数表达式为:K=______________________
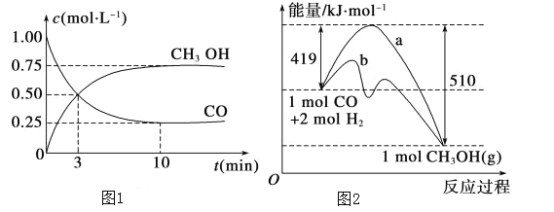
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)=____________。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是________(填“吸热”或“放热”)反应,反应的热化学方程式是__________________________________________。
(4)适宜的催化剂能_______(选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有________(选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
【答案】K= ![]() 0.075mol·L-1·min-1 放热 CO (g)+2H2 (g)
0.075mol·L-1·min-1 放热 CO (g)+2H2 (g) ![]() CH3OH (g) △H=-91kJ·mol-1 b. c c
CH3OH (g) △H=-91kJ·mol-1 b. c c
【解析】
(1)根据平衡常数的定义写出CO (g)+2H2 (g)![]() CH3OH (g),反应的平衡常数表达式为:K=
CH3OH (g),反应的平衡常数表达式为:K=![]() ;
;
(2)根据题列三段式,再结合v=浓度的变化量与时间的变化量比值进行计算;
(3)根据图可知,1molCO和2molH2生成1molCH3OH能量减少(510-419)kJ,据此书写;
(4)根据催化剂的作用分析,催化剂可以加快反应速率,但不影响平衡移动;;
(5)根据影响化学平衡的因素分析;
(1)根据平衡常数的定义:CO (g)+2H2 (g)![]() CH3OH (g),反应的平衡常数表达式为:K=
CH3OH (g),反应的平衡常数表达式为:K=![]() ;
;
故答案为:![]() ;
;
(2)列三段式:
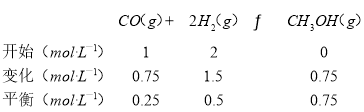
从反应开始到平衡,CO的平均反应速率v(CO)=![]() =0.075 mol·L-1·min-1;
=0.075 mol·L-1·min-1;
故答案为:0.075mol·L-1·min-1;
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。根据图可知,1molCO和2molH2生成1molCH3OH能量减少(510-419)kJ,是放热反应,故其热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-91kJ·mol-1;
故答案为:放热;CO(g)+2H2(g)=CH3OH(g)△H=-91kJ·mol-1;
(4)适宜的催化剂:a.不改变反应的热效应,故不选; b.降低反应所需活化能,降低生产能耗 ,故选;c.加快反应速率,缩短反应时间,故选; d.不能改变平衡,不能提高反应物的转化率,故不选;故选b. c;
(5)a.升高温度,平衡向着逆方向移动,则![]() 减小,故a错误;
减小,故a错误;
b.使用催化剂,催化剂不影响化学平衡,则![]() 不变,故b错误;
不变,故b错误;
c.再充入2molH2,反应物浓度增大,平衡正向移动,则![]() 增大,故c正确;
增大,故c正确;
故选c。


科目:高中化学 来源: 题型:
【题目】25℃时,用0.100 mol/L盐酸溶液滴定25.00 mL 0.100 mol/L的氨水溶液,滴定曲线如图所示,下列有关说法不正确的是

A.可用甲基橙指示剂
B.a点所示溶液中,c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+)
C.水的电离程度b点所示溶液大于a点所示溶液
D.c点所示溶液中,c(Cl-)+2c(OH-)=2c(H+)-2c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol/LNaOH溶液中,逐滴加入10 mL浓度为c mol/L的HF稀溶液。已知 25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ/mol ②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。请根据信息判断,下列说法中不正确的是
A.整个滴加过程中,水的电离程度不一定存在先增大后减小的变化趋势
B.将氢氟酸溶液温度由25℃升高到35℃时,HF的电离程度减小(不考虑挥发)
C.当c>0.1时,溶液中才有可能存在c(Na+)=c(F-)
D.若滴定过程中存在:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在生产和生活中有重要意义。海水中CO2的吸收能力取决于溶解的碳酸盐和硼酸盐生成的CO32-和B(OH)4-浓度。已知:298K时,H3BO3+H2O![]() H++B(OH)4-,Ka=5.7×10-10,碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
H++B(OH)4-,Ka=5.7×10-10,碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
(1)298K时,相同浓度的碳酸钠溶液和硼酸钠溶液,pH较大的是_______溶液。
(2)少量CO2与B(OH)4-反应的离子方程式为___________。
(3)采用高温熔融混合碳酸盐LiaNabKcCO3作电解质吸收并电解CO2制得无定型炭是CO2 资源化利用的一种新途径。此法的阴极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20mL气体,再将该气体用足量水吸收,剩余2.10mL气体(气体体积在同温同压下测定),则杂质不可能
A.只是NaNO3B.只是AgNO3C.只是NaClD.是NaNO3和AgNO3的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用氨碱法制取碳酸钠的原理,在实验室设计下列模拟装置制备NaHCO3(铁架台、C装置水浴中的温度计、酒精灯等略去),然后再制取Na2CO3。提供的试剂有:硫酸、盐酸、石灰石、浓氨水、碳酸氢钾溶液、水、生石灰、食盐等。
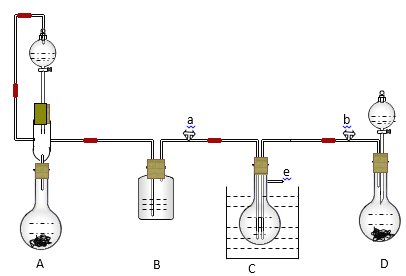
(1)在A中分液漏斗和烧瓶中加入的试剂分别是________、_________;D中分液漏斗和烧瓶中加入的试剂分别为______、________;
(2) B中加入的试剂是______________, 作用是________________________________。
(3)写出C中生成的NaHCO3化学方程式:____________________________________________。
(4)装置A中分液漏斗上方装一导管的主要作用是____________________________________。
(5)实验开始a、b两活塞的正确操作应是(选填序号)_______。
①同时打开a、b两活塞 ②先打开a,后打开b ③先打开b,后打开a
(6)检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是____________________。
(7)由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、_____。
(8)从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源,改进的方法是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中2 mol NO与1 mol O2充分反应,产物分子的数目为2NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA
C.标准状况下,22.4 L CCl4含CCl4分子数为NA
D.标准状况下,22.4L N2与CO混合气体的质量为28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
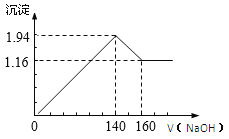
求:(1)合金中Mg,Al的质量_______________;
(2)所用HCl的物质的量浓度_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5mol A和6mol B的混合气体通入4L的密闭容器中,在一定条件下发生如下反应:5A(g)+4B(g)![]() 6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1molL-1min-1.下列计算结果正确的是
6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1molL-1min-1.下列计算结果正确的是
A.x的数值是2B.A的转化率为50%
C.B的平衡浓度为2mol/LD.反应前后混合气体的压强之比为22:25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com