
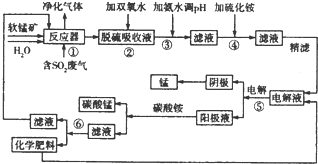
| 阳离子 | Fe2+ | Fe3+ | Mn2+ | Ni2+ | Co2+ | |
| 氢氧化物沉淀 | 开始沉淀的PH | 7.5 | 2.2 | 8.8 | 6.4 | 9.0 |
| 完全沉淀的PH | 9.5 | 3.5 | 10.8 | 8.4 | ||
| 硫化物沉淀 | 开始沉淀的PH | 6.2 | 4.67 | |||
| 完全沉淀的PH | ||||||
分析 二氧化硫与软锰矿浆作用生成硫酸锰和少量的硫酸铁、硫酸亚铁等,氧化环节:双氧水可将亚铁离子氧化为铁离子;加氨水调节溶液的PH把铁离子转化为沉淀除去;加硫化铵把重金属转化为沉淀除去;通过电解得到金属锰;在阳极液中加碳酸氢铵得碳酸锰和硫酸铵等,由此分析解答.
解答 解:二氧化硫与软锰矿浆作用生成硫酸锰和少量的硫酸铁、硫酸亚铁等,氧化环节:双氧水可将亚铁离子氧化为铁离子;加氨水调节溶液的PH把铁离子转化为沉淀除去;加硫化铵把重金属转化为沉淀除去;通过电解得到金属锰;在阳极液中加碳酸氢铵得碳酸锰和硫酸铵等,
(1)喷射鼓泡反应器,并不断搅拌,采用这种设备的好处是增大二氧化硫与二氧化锰的接触面积,使其充分反应,从而提高反应速率,缩短反应的时间,提高经济效益,锰由+4价变成+2价,铁离子还原成亚铁离子,故答案为:增大二氧化硫与二氧化锰的接触面积,使其充分反应,从而提高反应速率;亚铁离子、锰离子;
(2)亚铁离子被氧化成铁离子,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)若步骤③调节pH使用的是NaOH溶液,引入钠离子,则导致的后果是后续得到有化学肥料中含有硫酸钠,故答案为:后续得到有化学肥料中含有硫酸钠杂质;
(4)由表中的信息PH=6.2,锰离子开始沉淀,所以防止锰离子生成硫化锰沉淀,故答案为:防止锰离子生成硫化锰沉淀;
(5)步骤⑤所用是电解设备名称为电解槽,故答案为:电解槽;
(6)滤液中含有铵根离子和硫酸根离子,所以步骤⑥的化学肥料为硫酸铵,电解过程中加入硫酸铵是增加溶液的导电性,故答案为:硫酸铵;增加溶液的导电性.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强变小 | |
| B. | 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度平衡常数增大 | |
| D. | 其他条件不变,使用不同催化剂,HCl(g)的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 有机酸X的数目 | 醇Y的数目 |
| A | 4种 | 3种 |
| B | 4种 | 2种 |
| C | 5种 | 3种 |
| D | 5种 | 2种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 操作 | 现象 |
通入氯气至过量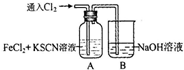 | Ⅰ、A中溶液变红 Ⅱ、稍后,溶液由红色变为黄色 |
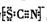 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的第一电离能比镁的第一电离能大 | |
| B. | 钾的第一电离能比镁的第一电离能大 | |
| C. | 在所有的元素中,F的第一电离能最大 | |
| D. | 第3周期所含元素中钠的第一电离能最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1a mol | B. | (0.1+a)mol | C. | (0.05+a)mol | D. | 2a mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com