
| A. | 恒温恒容条件下,在工业合成氨反应中,增加氮气的量 | |
| B. | 将稀硫酸改为98%的浓硫酸与Zn反应制取H2 | |
| C. | 在H2SO4与NaOH两溶液反应时,增大压强 | |
| D. | Na与水反应时增大水的用量 |
分析 常见增大化学反应速率的措施有:增大浓度、压强,升高温度,使用催化剂等,增大单位体积的活化分子数目或增大活化分子百分数,从而增大反应速率,注意增大压强只对有气体参加的反应有影响,以此解答该题.
解答 解:A.恒温恒容条件下,在工业合成氨反应中,增加氮气的量,反应物浓度增大,则反应速率增大,故A正确;
B.将稀H2SO4改为98%的浓H2SO4与Zn反应生成二氧化硫气体,不生成氢气,故B错误;
C.反应在溶液中进行,没有气体生成,增大压强,反应速率基本不变,故C错误;
D.水为纯液体,增大水的用量,浓度不变,反应速率不变,故D错误.
故选A.
点评 本题考查化学反应速率的影响,侧重于学生的分析能力的考查,为高频考点,注意相关基础知识的积累,易错点为B,注意浓硫酸的性质,难度不大.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题
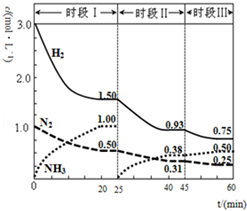 N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.
N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊 | C6H5O-结合质子的能力比SO32-强 |
| B | 向待测液X中依次滴入氯水、KSCN溶液,溶液变红 | 待测液X中一定含有Fe2+ |
| C | 向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色 | S2O82-氧化性比MnO4-强 |
| D | 浓硫酸与乙醇共热产生的气体Y,通入酸性KMnO4溶液,溶液紫色褪去 | 气体Y为纯净的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na在空气中燃烧,发出黄色火焰 | B. | Na在空气中燃烧,产物是Na2O | ||
| C. | Na是银白色金属,硬度小,熔点低 | D. | Na、K合金可作原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m-16)g | B. | (m+16)g | C. | (m-32)g | D. | 16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率加快 | |
| B. | 提高起始的反应温度,正反应速率加快,逆反应速率减慢,平衡正向移动 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol Ne,反应速率加快,平衡正向移动 | |
| D. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com