
【题目】下图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程
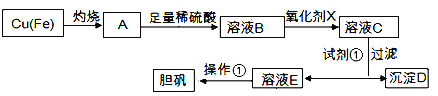
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是________(填字母)。
A. NaClO B. H2O2 C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择________(填化学式)。
(3)操作①的名称是________。
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是________。
A. 将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B. 向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C. 将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D. 向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5) 沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是________________(用离子方程式表示)。
【答案】 B CuO或CuCO3或Cu(OH)2 蒸发结晶 C Fe+2Fe3+=3Fe2+
【解析】试题分析:(1)次氯酸钠、过氧化氢、高锰酸钾均可氧化亚铁离子为铁离子,但次氯酸钠、高锰酸钾做氧化剂时,会产生其他杂质,而过氧化氢做氧化剂,只被还原为水,不会引入新的杂质,所以答案选B;
(2)加入试剂①,调节溶液的pH,目的是时铁离子沉淀,所以加入的试剂为铜试剂,可与硫酸反应生成硫酸铜,则可以是CuO或CuCO3或Cu(OH)2中的一种;
(3)从溶液中得到晶体的操作为蒸发浓缩,冷却结晶,过滤;
(4)A、沸水中加入饱和氯化铁溶液,加热至溶液为红褐色时,可得到氢氧化铁胶体,可产生丁达尔效应,A正确;B、氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀,B正确;C、氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀,将氢氧化铁干燥灼烧后得到氧化铁固体,因为氢氧化铁受热分解生成氧化铁和水,C错误;D、铁离子与KSCN溶液反应生成血红色的络合物,溶液变红色,D正确,答案选C;
(5)沉淀D是氢氧化铁,与盐酸反应生成氯化铁和水,氯化铁与铁反应生成氯化亚铁,所以实验室保存FeCl2溶液时,加入铁粉,目的是防止亚铁离子被氧化,离子方程式是Fe+2Fe3+=3Fe2+。


科目:高中化学 来源: 题型:
【题目】根据要求写出下列反应的方程式:
(1)Al粉和NaOH溶液反应的化学方程式: _________________________________。
(2)漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。
(3)铁粉和水蒸气反应化学方程式:_______________________________________。
(4)Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。
(5)NaAlO2溶液中通入少量CO2,发生反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g)![]() 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
A. 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3
B. 平衡混合物体积是反应开始前的3/5
C. 平衡混合物中各物质的量浓度相等
D. 单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为____________,A的官能团为_________(填名称)。
(2)下列物质中,不能通过乙烯加成反应得到的是_________(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(3)已知2CH3CHO+O2 ![]() 2CH3COOH若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH若以乙烯为主要原料合成乙酸,其合成路线如下图所示:![]()
a. 反应②的化学方程式为______________________________。
b. 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为______________________________,反应类型是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①月球上某矿石经处理得到的MgO中含有少量SiO2,用NaOH溶液除去SiO2的化学方程式为______。
②MgO与炭粉和氯气在一定条件下反应可制备MgCl2,尾气中的氯气可用足量冷的NaOH溶液完全吸收,则生成的盐为_________、_________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某工厂的工业废水中含有大量的FeSO4和较多的Fe3+和Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:

(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为________________________。
(2)加入过量物质1后,发生反应的离子方程式为___________________________。
(3)固体2是_____________________,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入_______________________。
Ⅱ.工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________(填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式__________________________。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
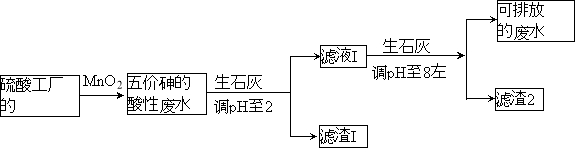
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物 | Ksp |
Ca3(AsO4)2 | 6.8×10-19 |
CaSO4 | 9.1×10-6 |
FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
污染物 | H2SO4 | As |
废水浓度 | 29.4g/L | 1.6g·L-1 |
排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com