
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理如图。该电池在使用过程中石墨1电极上生成氧化物Y。下列说去错误的是

A. 若将该电池中的熔融NaNO3换成NaOH溶液,则不可能产生电流
B. 该电池放电时NO3-从右侧向左侧迁移
C. 石墨I电极的电极反应式为NO2+NO3--e-=N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4︰1
科目:高中化学 来源: 题型:
【题目】混合物分离和提纯常用下图装置进行,按要求回答下列问题:

(1)仪器①的名称__________。
(2)除去澄清石灰水中悬浮的CaCO3颗粒应选用_______(填字母,下同)。
(3)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物应选用_______。
(4)用CCl4提取碘水中的碘单质应选用_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3mL酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数

(1)以上步骤有错误的是(填编号)________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.量取待测液的滴定管用蒸馏水洗涤后,未用待测液润洗
D.装标准溶液的滴定管滴定前仰视读数,滴定后俯视读
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课上,同学们利用下列实验探究碱的化学性质:

(1)A实验中观察到的现象是_______。
(2)B实验中发生的离子反应方程式是_____。
(3)C实验中发生的离子反应方程式是____。
(4)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。
(提出问题)废液中含有什么物质?
(假设猜想)通过分析,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有_____。
老师问:废液中还可能有什么物质?引发了同学们热烈讨论,下面是大家的发言:
学生甲 | 可能有CaCl2、Na2CO3 | 学生丙 | 可能有Ca(OH)2、CaCl2 |
学生乙 | 可能有NaOH、Na2CO3 | 学生丁 | 可能有Na2CO3 |
学生戊 | 可能有NaOH | … | … |
上述几位学生的猜想中,有一种明显不合理,你认为谁的猜想不合理?并说明理由。_____
(实验验证)同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
(结论)上述废液中,还含有____,没有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述在确的是
A. 等质量的CO与N2,质子数之比为1︰1
B. 标况下,相同体积的H2O和NH3含有的电子数相同
C. 1molO2分别与足量S、SO2反应,转移的电子数相同
D. 2 mol/L NH4CI溶液与1mol/L(NH4)2SO4溶液中,NH4+数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、二氧化碳、氧气作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”(碱式碳酸铜),“铜绿”能跟酸反应生成铜盐、二氧化碳和水。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于物质的类别是____。
(2)请写出铜绿与盐酸反应的化学方程式_____。
(3)写出B的化学式_____。
(4)上述转化过程中属于化合反应的是___,属于复分解反应的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验)。
已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O、Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
MnCl2+Cl2↑+2H2O、Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
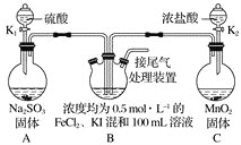

(1)上述实验需要加热的装置是_____。
(2)D中烧杯盛放的是____。
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式___。
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入___溶液,现象是____。
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是___。
A.关闭K2打开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如下:
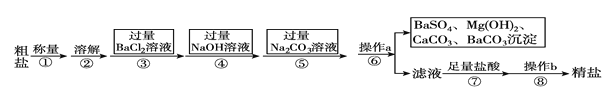
(1)操作a的名称为________,在操作b中玻璃棒的作用是_____________________。
(2)进行步骤③后,判断BaCl2过量的方法是______________________________(写出步骤、现象)。
(3)步骤⑦中能用稀硫酸代替稀盐酸吗?________(填“能”或“不能”),原因是_____________。
(4)某氯化钾样品中含杂质硫酸钾,为了除去硫酸钾,要做以下实验:
A.向滤液中滴加稀盐酸,边滴边振荡至不再产生气体
B.将氯化钾样品溶于适量蒸馏水,配成溶液
C.过滤,将白色沉淀滤出
D.向溶液中加入过量碳酸钾溶液,边滴边振荡至不再产生白色沉淀
E.向溶液中加入过量氯化钡溶液,边滴边振荡至不再产生沉淀
F.将滤液蒸干,得到晶体
①正确的实验操作顺序为______________(填写序号)。
②进行F操作时用到的仪器主要有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10 mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图。下列说法正确的是

A. 对两种弱酸滴定均可选用甲基橙作指示剂
B. ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH)
C. 溶液中水的电离程度:②>③>④
D. 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com