
【题目】某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验)。
已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O、Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
MnCl2+Cl2↑+2H2O、Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
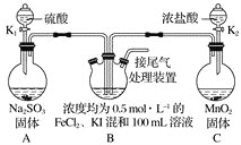

(1)上述实验需要加热的装置是_____。
(2)D中烧杯盛放的是____。
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式___。
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入___溶液,现象是____。
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是___。
A.关闭K2打开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为_____。
【答案】C 氢氧化钠溶液(NaOH溶液) 2I-+Cl2=I2+2Cl- 淀粉溶液 溶液呈蓝色 A 0.56L
【解析】
(1)二氧化锰和浓盐酸在加热的条件下会发生反应生成氯气,所以需要加热的仪器是C。
(2)氯气属于有毒气体,可以用氢氧化钠溶液来吸收,所以D中烧杯盛放的是氢氧化钠溶液。
(3)亚铁离子和碘离子均具有还原性,能被氯气氧化,但是碘离子的还原性强于亚铁离子,所以少量的氯气可以将碘离子氧化,但是不能将亚铁离子氧化。反应的离子方程式为:2I-+Cl2=I2+2Cl-。
①碘离子可以被氧化为单质碘,碘单质遇到淀粉溶液变为蓝色,据此可以用淀粉溶液检验碘单质的产生。故答案为:淀粉溶液,溶液呈蓝色。
②比较SO2和I-的还原性强弱,可以根据二氧化硫能否和碘单质间的反应来判断,所以可以关闭K2打开K1。故选A。
(4)铁离子和二氧化硫之间的反应实质是SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,根据铁元素守恒,铁离子的物质的量是0.05mol,所以消耗二氧化硫的物质的量是0.025 mol,体积是0.025mol×22.4L·mol-1=0.56L。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.钠和钾的合金可用于快中子反应堆作热交换剂
B.石灰石可用于燃煤烟气的脱硫
C.用酒精可以萃取碘水中的I2
D.CO2可用于生产可降解高聚物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO3和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)===Se(s)+2H2 SO4(aq) △H1
2H2SeO4(aq)+Se(s)+ H2O (1)===3H2SeO3(ag) △H2
H2SeO4(aq)+ 3SO2(g)+2H2 O(1)===Se(s)+3H2 SO4 (aq) △H3
则△H2=___________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS),羰基硫的结构式为______________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示。

①阳极的电极反应式为_________________________________。
②电解一段时间后,向电解液中补充一定量的_______________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按![]() 的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。

①a___________(填“>”或”<”)0;压强p1、p2、p 3由小到大的顺序是___________。
②T1℃时,若向该容器中充入2.0mol H2和2.0 mol CO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=___________mol·L-1·min-1,N点对应条件下反应的平衡常数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理如图。该电池在使用过程中石墨1电极上生成氧化物Y。下列说去错误的是

A. 若将该电池中的熔融NaNO3换成NaOH溶液,则不可能产生电流
B. 该电池放电时NO3-从右侧向左侧迁移
C. 石墨I电极的电极反应式为NO2+NO3--e-=N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机研究开创绝不无“钴”的时代,例如:CoCl2·6H2O是一种饲料营养强化剂、草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
(1)浸出过程中加入Na2SO3的主要离子方程式为____________________。
(2)加入 NaClO3发生可以将溶液中Fe2+氧化,进而调节pH除去,但不能向“浸出液”中加过量 NaClO3的主要原因是:__________________。
(3)若“滤液Ⅰ”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___________mol/L。[已知Ksp(CaF2)=4.0×10-11]
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是___________;其使用的适宜pH范围是___________(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;用化学方程式表示从A点到B点的物质转化___________。C点所示产物的化学式是___________。(Co的相对原子质量是59)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法错误的是:
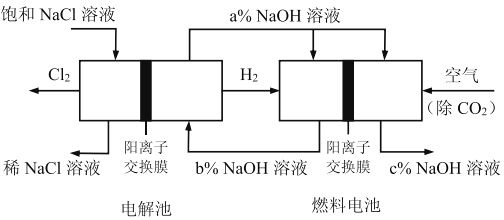
A. 电解池的阴极反应式2H2O+2e-=H2+2OH-
B. 相同条件下,当电解池生成2LCl2,理论上燃料电池应消耗1LO2
C. 电解池中阳离子移动流向阴极池
D. 溶液a、b、c的pH大小顺序为:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述不正确的是( )

A. 该滴定过程应选择甲基橙作为指示剂
B. M点对应的盐酸体积小于20.0 mL
C. M点: c(NH4+)+ c(NH3·H2O) =c(Cl-)
D. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于吸热反应的是( )
A. 生石灰与水的反应B. 甲烷在氧气中燃烧
C. Fe与稀盐酸的反应D. Ba(OH)2·8H2O和NH4 Cl(固体)反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com