
【题目】维生素C(C6H8O6)广泛存在于新鲜水果和蔬菜中,在人体内有重要的功能。维生素C属于
A.有机物B.单质C.氧化物D.盐
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 摩尔是国际单位制中七个基本物理量之一
B. 铁的摩尔质量就是铁原子的相对原子质量
C. 含有NA个氧原子的硫酸的物质的量是0.25mol
D. 40gNaOH溶于1L水,溶质的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述在确的是
A. 等质量的CO与N2,质子数之比为1︰1
B. 标况下,相同体积的H2O和NH3含有的电子数相同
C. 1molO2分别与足量S、SO2反应,转移的电子数相同
D. 2 mol/L NH4CI溶液与1mol/L(NH4)2SO4溶液中,NH4+数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向0.1moLH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。已知常温下,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。下列说法错误的是

A. 当溶液中c(S2-)=1.4×10-19mol/L时,溶液中由水电离出的H+浓度为1.0×10-13mo/L
B. 0.1mo/LNa2S溶液中离子浓度之间的关系为:c(Na+)>c(HS-)+2c(S2-)
C. 常温下,0.1 mol/L NaHS溶液的pH<7
D. 当pH=13时,溶液中的c(H2S)+c(HS-)=0.043mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验)。
已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O、Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
MnCl2+Cl2↑+2H2O、Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
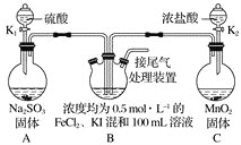

(1)上述实验需要加热的装置是_____。
(2)D中烧杯盛放的是____。
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式___。
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入___溶液,现象是____。
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是___。
A.关闭K2打开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法不正确的是
A.乙醇的燃烧是放热反应
B.Mg与盐酸的反应是吸热反应
C.反应物化学键的断裂要吸收能量
D.化学反应伴随有能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对炼锌厂的铜镉废渣中各元素进行分离,能减少环境污染,同时制得食品锌强化剂的原料ZnSO4·7H2O实现资源的再利用。其流程图如下。

[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO![]() 。
。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高铜镉废渣浸出率可以采用的方法是(写出其中一点即可)____;
(2)向滤液I中逐滴滴人酸性KMnO4溶液可与AsO![]() 发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____;
(4)上述流程除了实现对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用,还可以得到副产物___
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池的工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的正极反应式为____;
(6)若a克铜镉废渣含有b molFe元素,加入了c mol KMnO4,则铜镉废渣中As元素的质量分数为____。(不考虑镉元素与KMnO4的反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com