
【题目】下列叙述中正确的是( )
A. 摩尔是国际单位制中七个基本物理量之一
B. 铁的摩尔质量就是铁原子的相对原子质量
C. 含有NA个氧原子的硫酸的物质的量是0.25mol
D. 40gNaOH溶于1L水,溶质的物质的量浓度为1mol·L-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示) ;A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式 ; A2D由液态形成晶体时密度 (填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示) ;若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
| 1×105 | 5×105 | 1×106 | 5×106 | 1×107 |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)实际生产中,选定400~500℃作为操作温度,其原因是_______________________。
(2)实际生产中,采用的压强为常压,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将0.10mol/L的NaOH溶液逐滴滴入20 mL 0.10 mol/LCH3COOH溶液中,pH随滴入NaOH溶液体积的变化如下图所示。

(1)点①存在的电离平衡是___________。
(2)点②两溶液发生反应的离子方程式是_______。
(3)点③溶液的pH_____7(填“>”、“<”或“=”),此时c(Na+)_____c(CH3COO-)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液(阳离子为Na+)中可能含SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量。已知Br2溶于水得到橙色溶液。下列说法不正确的是( )
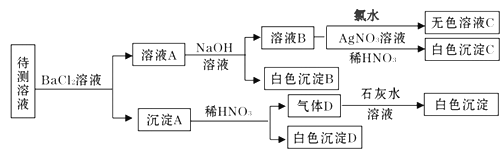
A. SO42-、SO32-至少含有一种B. 沉淀B的化学式为BaCO3
C. 肯定存在的阴离子有CO32-、HCO3-、Cl-D. Br- 肯定不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO3和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)===Se(s)+2H2 SO4(aq) △H1
2H2SeO4(aq)+Se(s)+ H2O (1)===3H2SeO3(ag) △H2
H2SeO4(aq)+ 3SO2(g)+2H2 O(1)===Se(s)+3H2 SO4 (aq) △H3
则△H2=___________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS),羰基硫的结构式为______________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示。

①阳极的电极反应式为_________________________________。
②电解一段时间后,向电解液中补充一定量的_______________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按![]() 的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。

①a___________(填“>”或”<”)0;压强p1、p2、p 3由小到大的顺序是___________。
②T1℃时,若向该容器中充入2.0mol H2和2.0 mol CO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=___________mol·L-1·min-1,N点对应条件下反应的平衡常数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法中正确的是( )

A. Ⅰ图中如果MnO2过量,浓盐酸就可全部消耗完
B. 将Ⅰ图中MnO2换成浓硫酸,撤去酒精灯后可以用于制取少量HCl气体
C. Ⅱ图中铜丝在氯气中燃烧,生成棕黄色的烟
D. 若将Ⅲ图装置直接与Ⅰ图发生装置连接,可用于证明干燥的氯气无漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com